
肺癌診療ガイドラインにおけるヘルネクシオス®の位置付け
サイトへ公開:2026年01月16日 (金)
クイックリンク

肺癌診療ガイドライン2025年版において、HER2遺伝子変異陽性のIV期非小細胞肺癌(NSCLC)に対する二次治療以降の選択肢として、ヘルネクシオス®が新たに掲載されました。
本コンテンツでは、ガイドラインにおけるヘルネクシオス®の位置付けと、Beamion LUNG-1試験1,2)の結果について、静岡県立静岡がんセンター 副院長 高橋 利明先生にご解説いただきました。
肺癌診療ガイドライン2025年版にヘルネクシオス®が掲載3)
HER2遺伝子変異陽性NSCLCにおいて、一次治療では使用可能な分子標的治療薬がなく、ドライバー遺伝子変異/転座陰性例の初回治療に準じた治療を行います。
二次治療以降では、これまで分子標的治療薬は一剤のみでしたが、肺癌診療ガイドライン2025年版にヘルネクシオス®が掲載され、HER2遺伝子変異陽性肺癌において、初めてのTKI(チロシンキナーゼ阻害薬)が新たな選択肢として加わりました。ガイドラインでは、「二次治療以降でゾンゲルチニブ単剤療法を行うよう強く推奨する。」と記載されています。

試験概要
Beamion LUNG-1試験の第Ib相では、進行/転移性のHER2変異陽性NSCLC患者を対象に、ヘルネクシオス®の有効性と安全性を評価しました。
本試験では、日本を含む18ヵ国で241例が登録され、そのうち日本人患者は26例でした。
コホート1では、まず初めに用量最適化相として、治療歴のあるHER2変異陽性NSCLC患者を、ヘルネクシオス® 120mg群又は240mg群にランダムに割り付け、治療を実施しました。
その後、用量最適化相のデータを踏まえて、120mgを推奨用量とし、コホート1を含むすべてのコホートで240mg群への組入れは中止となりました。

試験結果
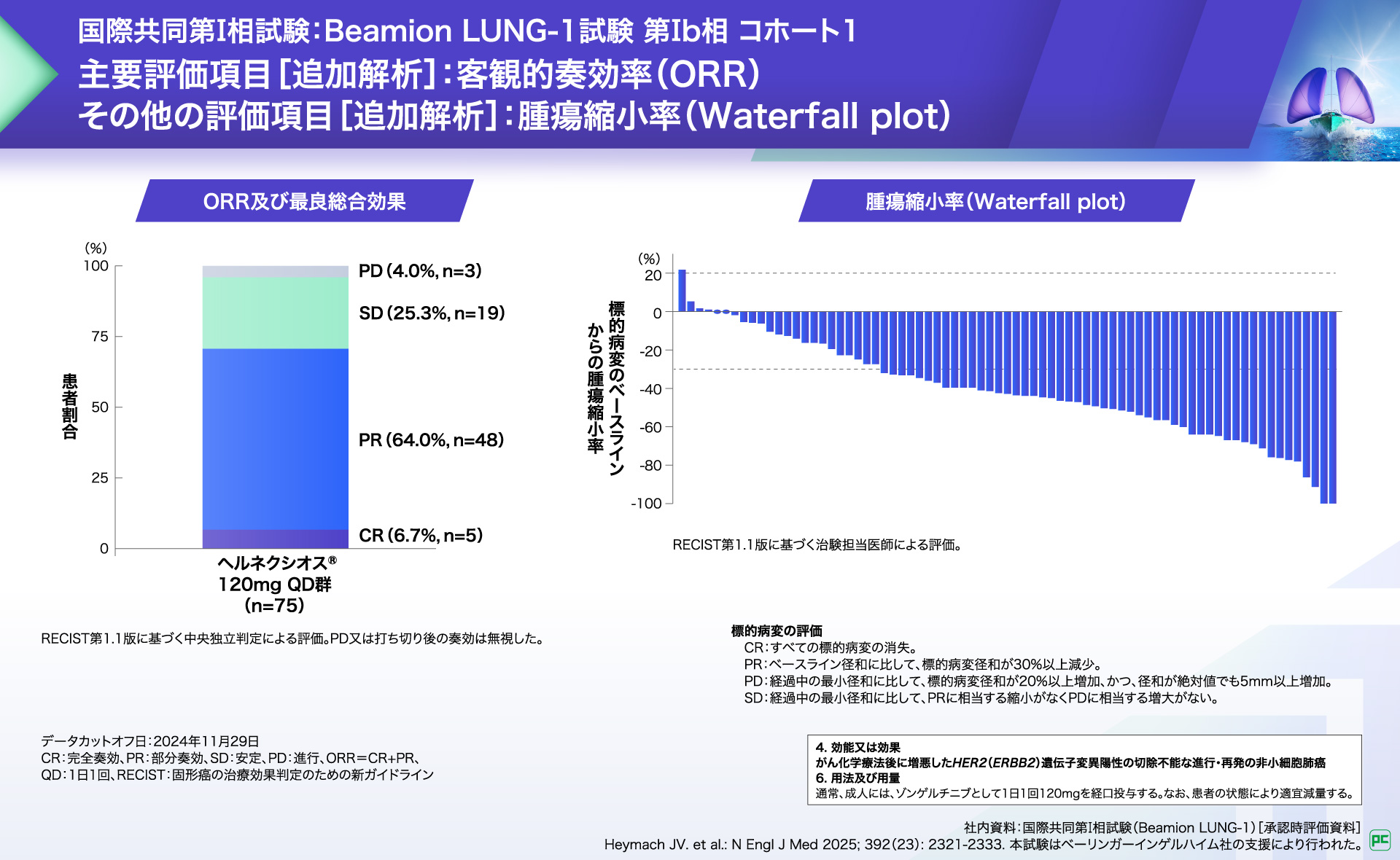
主解析において、主要評価項⽬である客観的奏効率(ORR※1)は66.7%(50/75例、97.5%CI︓53.8-77.5)と、事前に規定された基準(ORR 30%)を上回りました(⽚側p<0.0001、検証的な解析結果、1標本z検定)。
また、副次評価項⽬である病勢コントロール率(DCR※2)は92.0%でした。
※1:ORR=CR+PR、※2:DCR=CR+PR+SD

FDAの指示に基づき、コホート1の全患者の6ヵ月以上の奏効期間フォローアップデータ及び3ヵ月安全性データを更新するため、追加解析が実施されました。主要評価項⽬である客観的奏効率(ORR)は70.7%(53/75例、95%CI:59.6-79.8)でした。
また、ベースラインからの腫瘍縮⼩率の中央値は-43%(範囲:-100-22)でした。
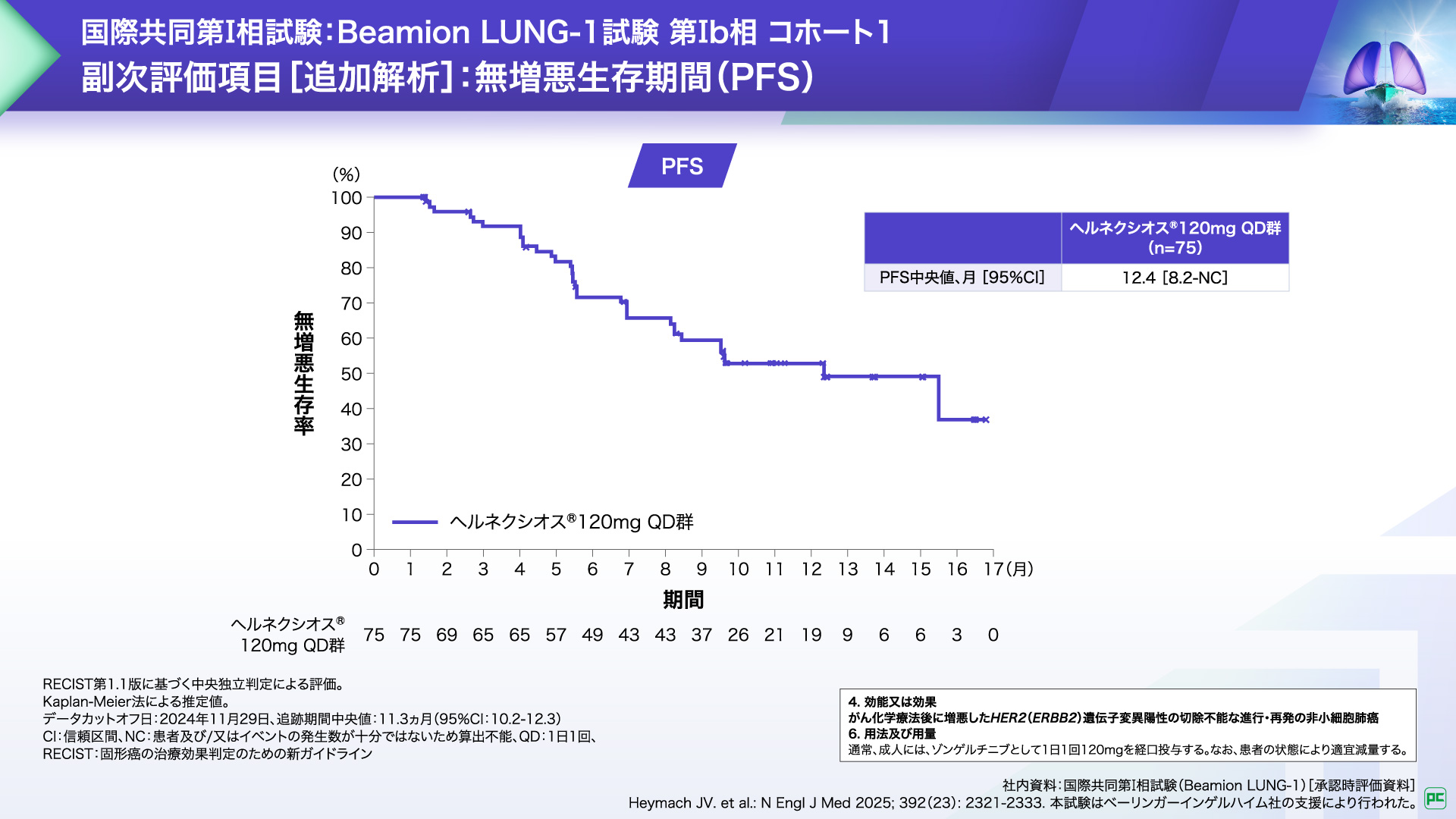
副次評価項目である無増悪生存期間(PFS)中央値は12.4ヵ月でした。
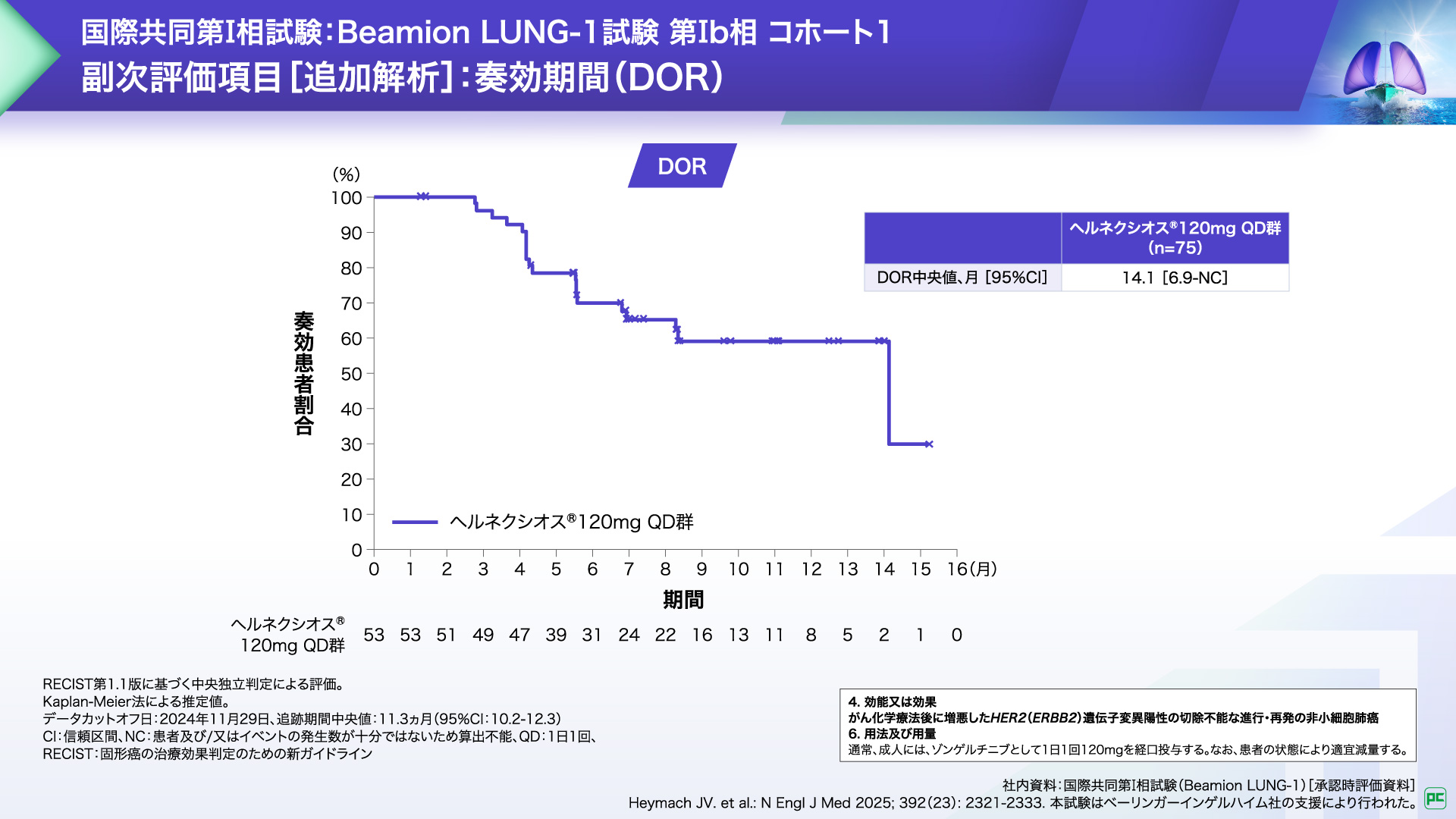
客観的奏効が認められた53例における奏効期間(DOR)中央値は14.1ヵ月でした。
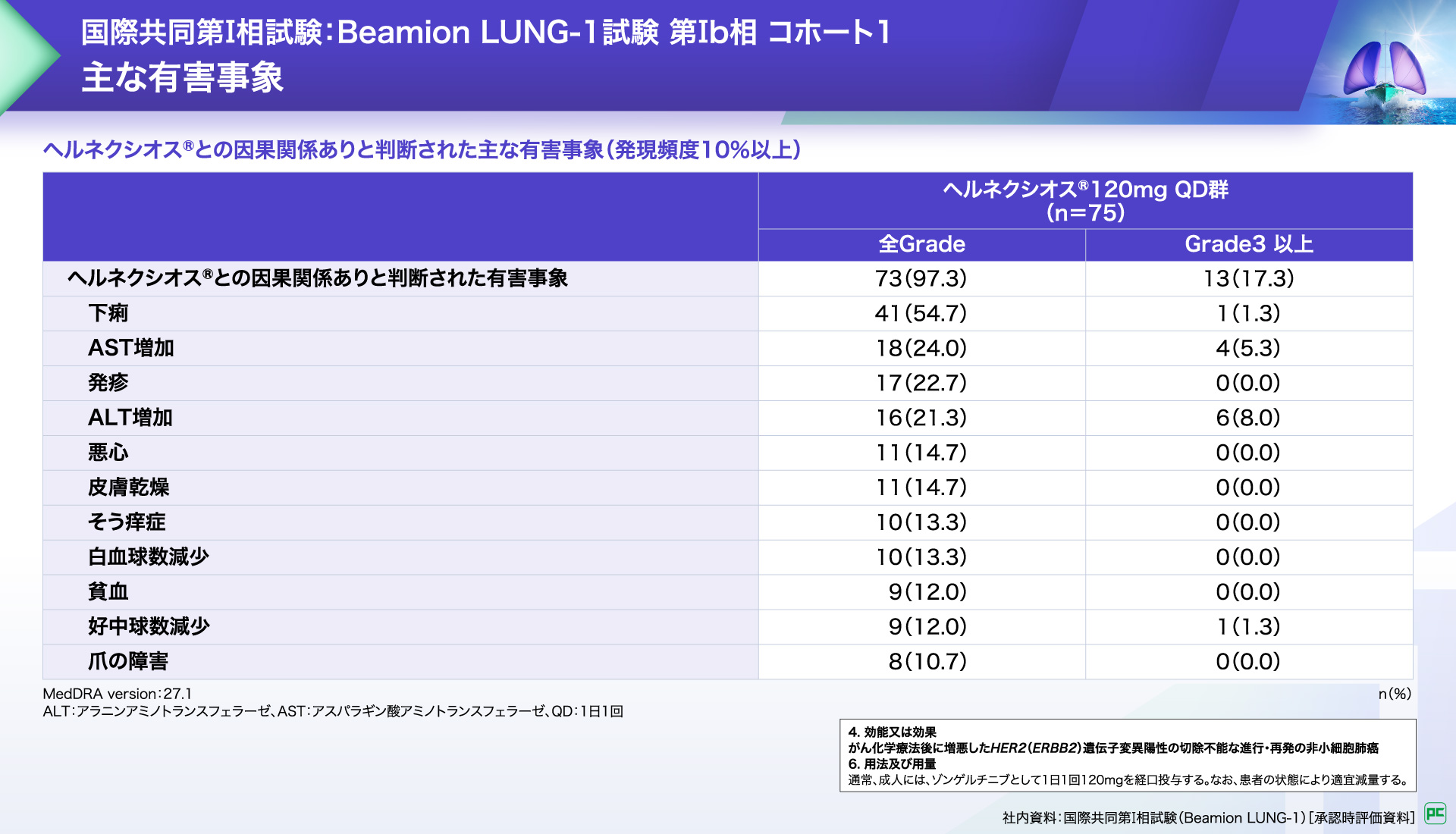
ヘルネクシオス®との因果関係ありと判断された有害事象は75例中73例(97.3%)に認められました。
主な有害事象は下痢(54.7%)、AST増加(24.0%)、発疹(22.7%)、ALT増加(21.3%)などでした。
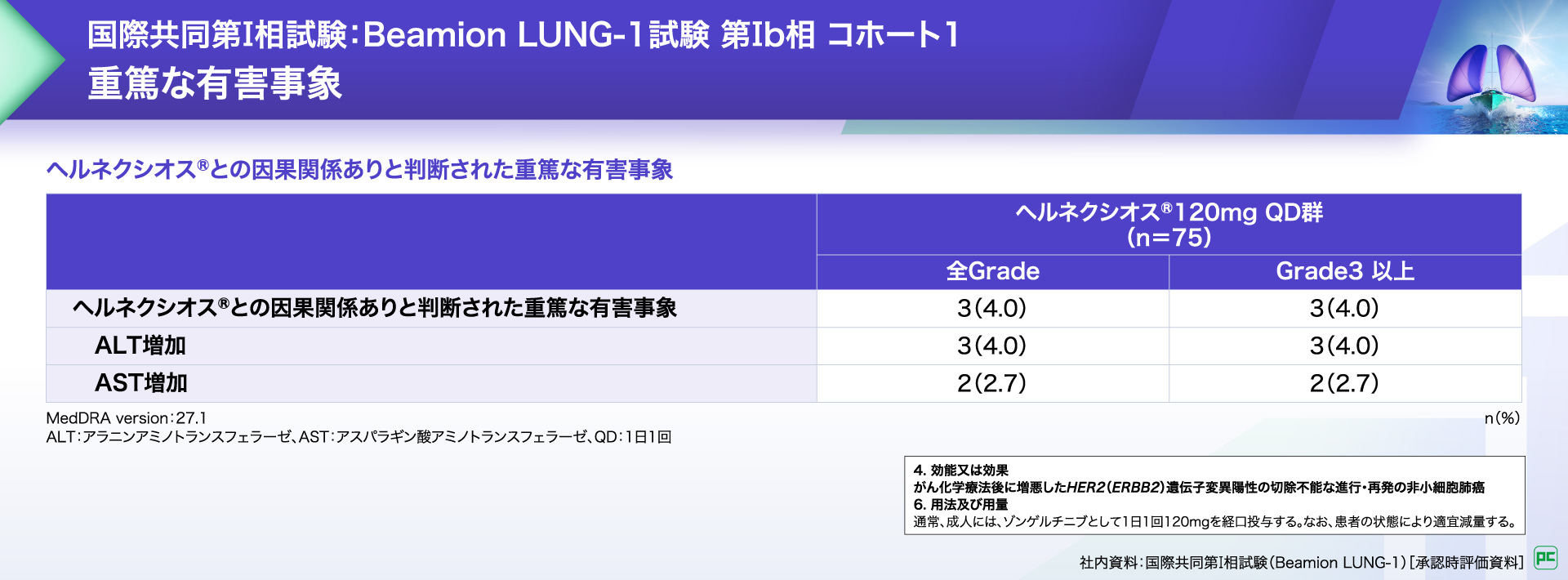
ヘルネクシオス®との因果関係ありと判断された重篤な有害事象は3例(4.0%)に認められ、ALT増加、AST増加が報告されました。
ヘルネクシオス®との因果関係ありと判断された死亡に至った有害事象は報告がありませんでした。
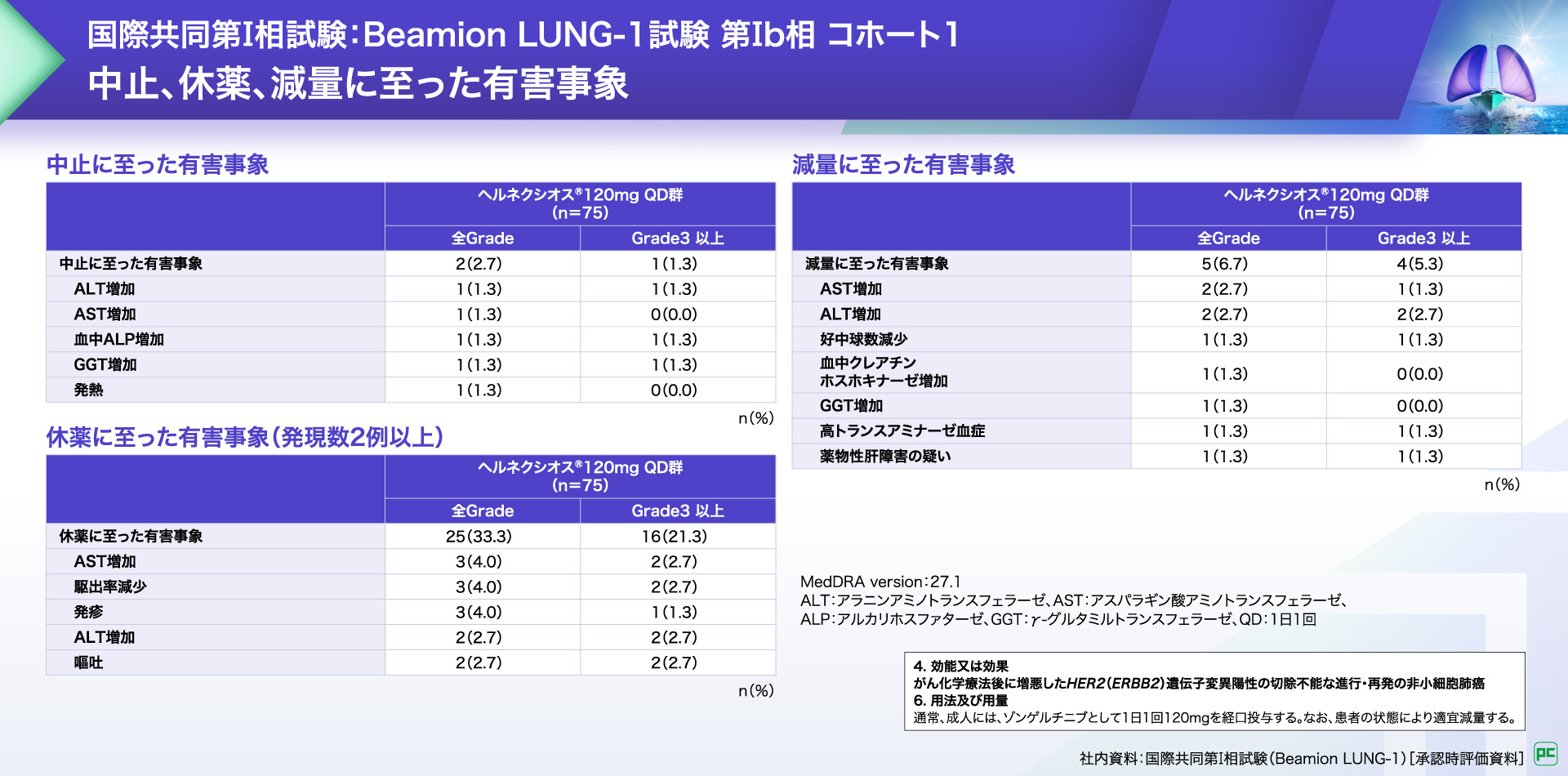
中止に至った有害事象は2例(2.7%)に認められ、ALT増加、AST増加、血中ALP増加、GGT増加及び発熱が報告されました。
休薬に至った有害事象は25例(33.3%)に認められ、2例以上にみられた有害事象はAST増加、駆出率減少、発疹、ALT増加及び嘔吐が報告されました。
減量に至った有害事象は5例(6.7%)に認められ、AST増加、ALT増加、好中球数減少、血中クレアチンホスホキナーゼ増加、GGT増加、高トランスアミナーゼ血症及び薬物性肝障害の疑いが報告されました。
【高橋先⽣のお⾔葉】
ヘルネクシオス®(一般名:ゾンゲルチニブ)は、「がん化学療法後に増悪したHER2(ERBB2)遺伝⼦変異陽性の切除不能な進⾏・再発の⾮⼩細胞肺癌」を効能⼜は効果として2025年9⽉に承認され、同年11月に発売されました。
肺癌診療ガイドライン2025年版では、HER2遺伝子変異陽性のIV期NSCLCに対する治療選択肢として、ヘルネクシオス®が新たに加わり、「二次治療以降でゾンゲルチニブ単剤療法を行うよう強く推奨する。」と記載されています。
ヘルネクシオス®の登場により、これまで治療選択肢が限られていたHER2遺伝子変異陽性肺癌の二次治療において、新たな治療の可能性が広がりました。ヘルネクシオス®はTKIであり、経口投与が可能な薬剤です。本コンテンツが、先生方の日常診療における治療方針決定の一助となれば幸いです。
- 社内資料:国際共同第I相試験(Beamion-LUNG 1)[承認時評価資料]
- Heymach JV. et al.: N Engl J Med 2025; 392(23): 2321-2333. 本試験はベーリンガーインゲルハイム社の支援により行われた。
- 日本肺癌学会編. 肺癌診療ガイドライン2025年版.(https://www.haigan.gr.jp/publication/guideline/examination/2025/1/2/250102070100.html#j_7-1-9)(2025年11月現在)
その他の関連情報

日本ベーリンガーインゲルハイム
メディカルチャット 利用規約
当社の「日本ベーリンガーインゲルハイム メディカルチャット」(以下「本サービス」といいます)のご利用に際しては、本利用規約が適用されますので、必ず以下の記載事項をご確認下さい。
利用規約
- 本サービスは、当社所定のウェブページから文字によりお問い合わせいただくことにより、当社医薬品等に関する一般的な情報を、人工知能あるいは当社担当者により、文字及び図表により回答するサービスです(以下、人工知能による回答サービスを「AIチャット」、当社担当者による回答サービスを「有人チャット」といいます。)。ただし、AIチャットによる回答を原則とし、有人チャットは、AIチャットでの回答に対し、有人チャットでの回答も希望された場合に、提供させていただきます。
- 本サービスをご利用いただくことができるのは、当社医薬品等を扱いかつ国内に在住する医療関係者の方に限られます。当該医療関係者以外の方は、ご利用いただくことができません。
- 本利用規約に同意いただけない場合、本サービスを利用いただくことができません。本利用規約を最後までお読みいただき、「同意して利用する」ボタンを押した上で、本サービスをご利用下さい。
- 本サービスは、当社医薬品等に関する一般的なお問い合わせに対して回答するものとし、次の各号に掲げるお問い合わせについては、回答しないものとします。
- 当社医薬品等と関係のないお問い合わせ、または本サービスの回答範囲を逸脱したお問い合わせ
- 具体的な症状や治療方法に関するお問合せ
- 当社に適用される法令、ガイドラインまたは行政上の指導、当社自主規制その他当社が遵守すべきルールにより回答できないお問い合わせ
- 文字化け等により入力内容が判断できないお問い合わせ
- 前各号に掲げるほか、本サービスにより、適切な回答をすることができないと当社が判断した事項に関するお問い合わせ
- 本サービスは、日本語のみに対応しています。
- 本サービスは、当社医薬品の副作用、不具合及び有害事象の報告を受け付けていません。
- お問い合わせの内容によっては、本サービスでは十分に回答できない場合もございます。予めご了承下さい。
- 本サービスの利用可能時間は、以下のとおりです。
- AIチャット
24時間365日 - 有人チャット
平日9:00~17:00
- AIチャット
- 前項に関わらず、メンテナンス及び障害等のため一時的に本サービスを中断する場合がございます。
本サービスのご利用の際には、原則として、個人情報(お名前、ご住所、電話番号、メールアドレス等)を入力しないようお願いします。ただし、AIチャット及び有人チャットを問わず、当社医薬品の適用外使用に関するお問い合わせについては、コンプライアンス上の理由により、当社より、氏名及び施設名の入力を求める場合がございます。この場合には、当社プライバシーポリシーの内容を確認いただき、同意いただける場合に限り、入力して下さい(プライバシーポリシーについては「VIII 利用規約、プライバシーポリシー」に記載のURLからアクセス下さい)。その他の場合に、当社より個人情報の入力を求めることは一切ございません。
- 当社医薬品のご使用にあたっては、最新の添付文書等をご確認下さい。
- 当社は、本サービスまたは本サービスにより提供される情報の利用に際し生じた結果については、一切責任を負いません。
本サービスの利用にあたり、以下の各号の行為を禁止します。
- 本サービスにより提供される情報を複製、複写、転載、改変等する行為
- 第三者または当社の知的財産権その他の権利を侵害する行為
- 第三者または当社を誹謗中傷し、または名誉・信用を毀損する行為
- 本サービスの利用による営利目的の行為
- 本サービスの運営又は他の利用者による本サービスの利用の妨げとなる行為
- 前各号のほか、当社が不適当であると判断する行為
当社は、いつでも本サービスの提供を終了、またはその内容を変更することができるものとします。
本サービスの利用に関しては、以下の利用規約及びプライバシーポリシーが併せて適用されますので、ご確認下さい。




