
抗線維化剤オフェブの適切な治療用量の考え方(静止画)
サイトへ公開:2025年03月28日 (金)
クイックリンク
ご監修:神田 友梨恵先生(産業医科大学医学部 第1内科学講座 助教)

関節リウマチに伴う間質性肺疾患(RA-ILD)を含む、進行性線維化を伴う間質性肺疾患(PF-ILD)の治療選択肢として、抗線維化剤オフェブがあります。オフェブは、患者さんの状態に応じて開始用量から「減量」が必要になる場合があり、関節リウマチ治療薬で一般的な「漸増」とは異なる対応が求められます。このような管理の違いに難しさを感じる先生もいらっしゃるかもしれません。
今回は、オフェブの投与開始時の用法及び用量(1回150mg 1日2回投与)の意義や、投与後の適切な管理方法についてご紹介します。オフェブの用法及び用量はIPF患者さんを対象とした臨床試験に基づいて設定されていることから、本コンテンツではこれらの試験結果を取り上げ、用法及び用量の意義について解説いたします。
オフェブと抗リウマチ薬・生物学的製剤の用量管理の違い
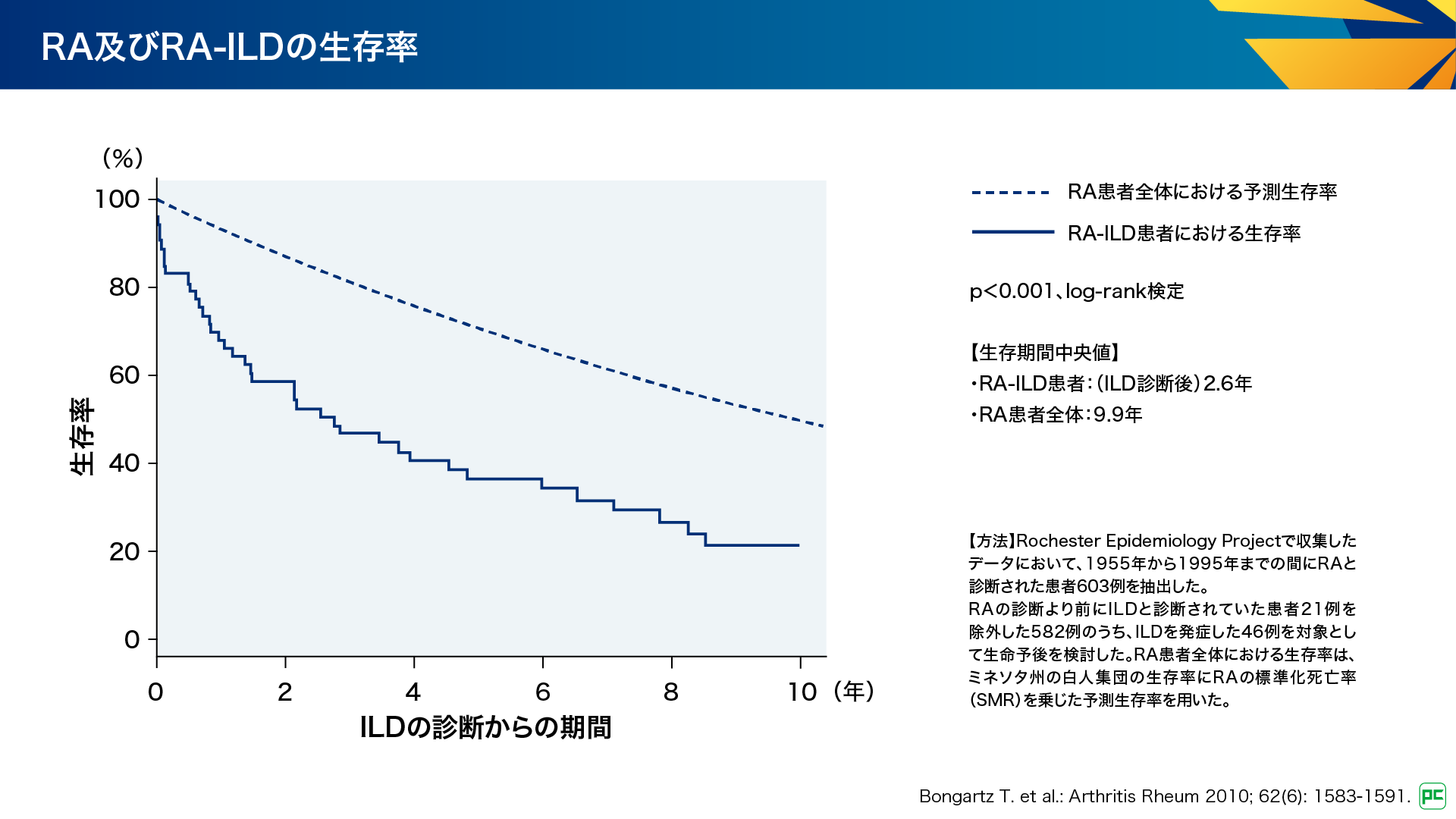
RA-ILDはRA患者さんの約28~67%にみられ1)、死亡原因の11.1%を占めることが報告されています2)。また、RA-ILD患者さんにおけるILD診断後の生存期間中央値は2.6年であり、RA患者さん全体の9.9年と比較して有意に短いことが示されています(図1)3)。このように、ILDはRA患者さんの予後に影響する重要な因子です。
図1
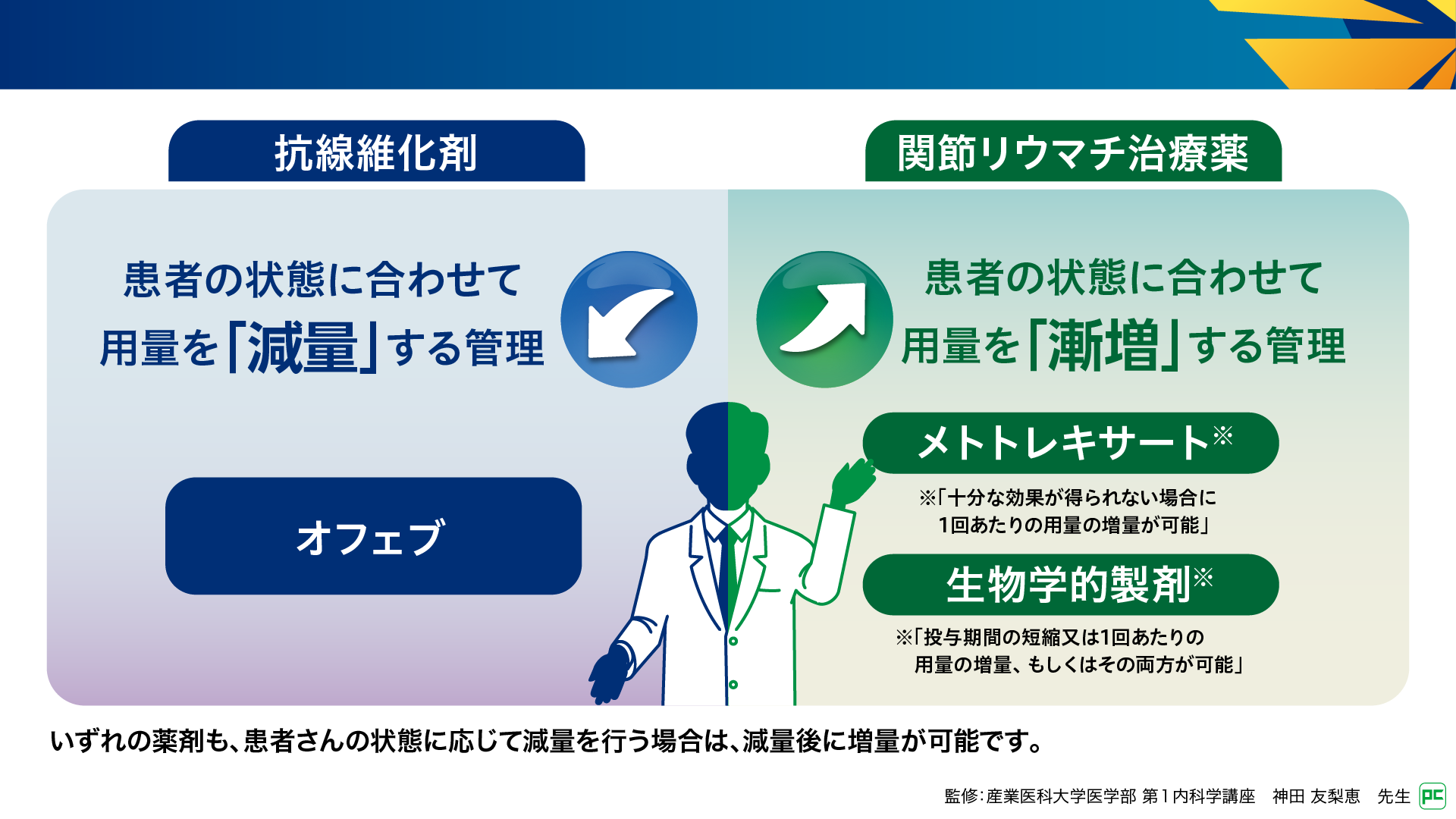
進行性線維化を伴うRA-ILDに対するオフェブ治療では、用量調節などを含めた適切な管理が重要となります。オフェブの投与開始時の用法及び用量は「1回150mgを1日2回、朝・夕食後に経口投与」であり、副作用への対応として「1回100mgの1日2回投与へ減量」が必要になることがあります(図2)4)。一方、関節リウマチ治療薬である抗リウマチ薬や生物学的製剤では、低用量から開始し治療目標が未達成の場合に用量を漸増する管理が行われます。例えば、メトトレキサートの経口投与では6~8mg/週で開始し、効果不十分であれば漸増して15~16mg/週まで増量可能です5)。このように、オフェブと関節リウマチ治療薬では異なる管理が求められます。
図2
次に、オフェブの用法及び用量を設定した根拠となる臨床試験についてみていきましょう。
オフェブの用量反応試験であるTOMORROW試験
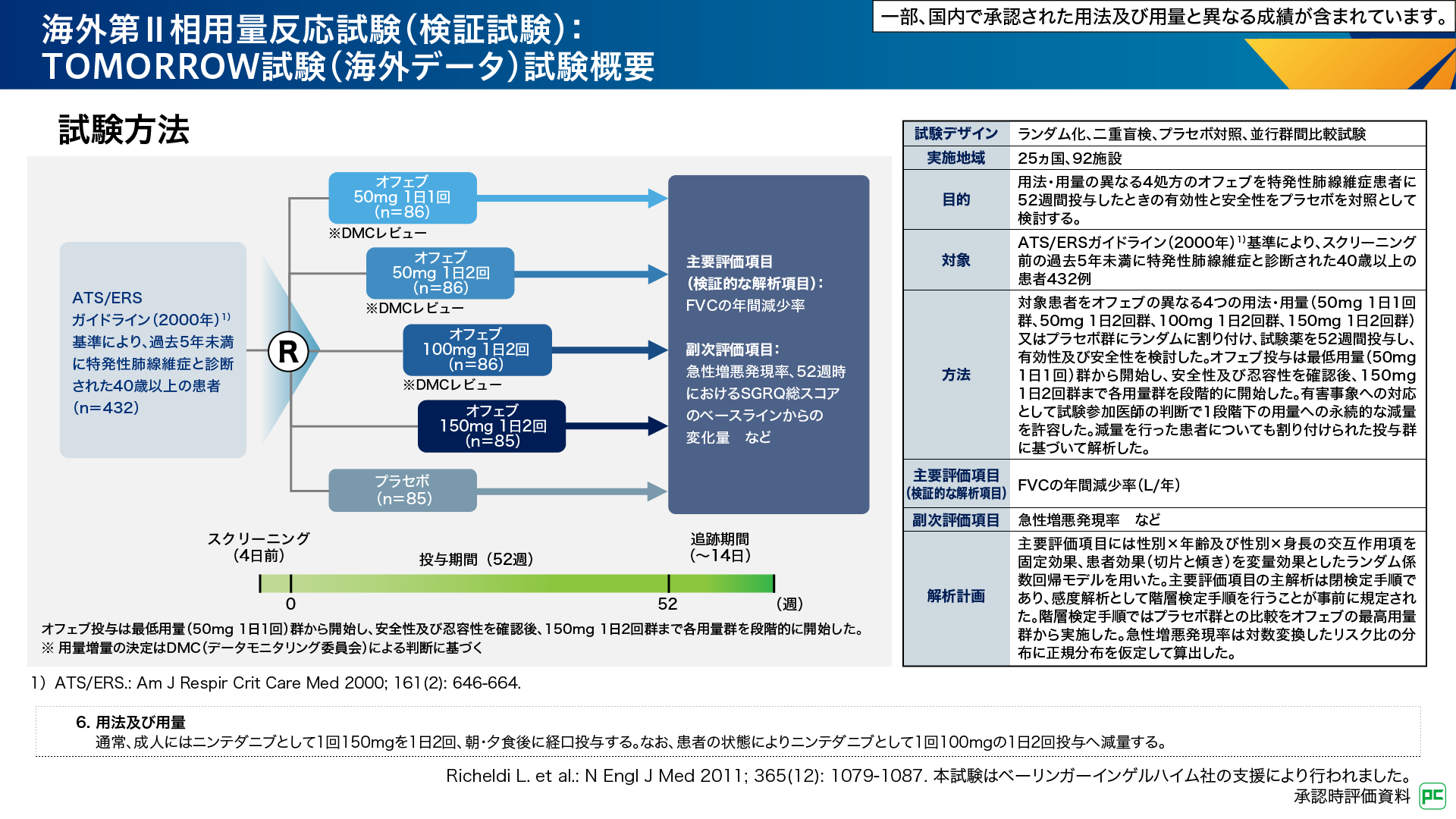
TOMORROW試験6,7)は、オフェブの異なる用法・用量における有効性及び安全性を検討した用量反応試験です(図3)。本試験では、IPF患者さん432例を用法・用量の異なる4つのオフェブ群あるいはプラセボ群にランダムに割り付け、試験薬を52週間投与しました。用量調節は、有害事象への対応として、試験参加医師の判断で1段階下の用量への減量が許容されました。
図3
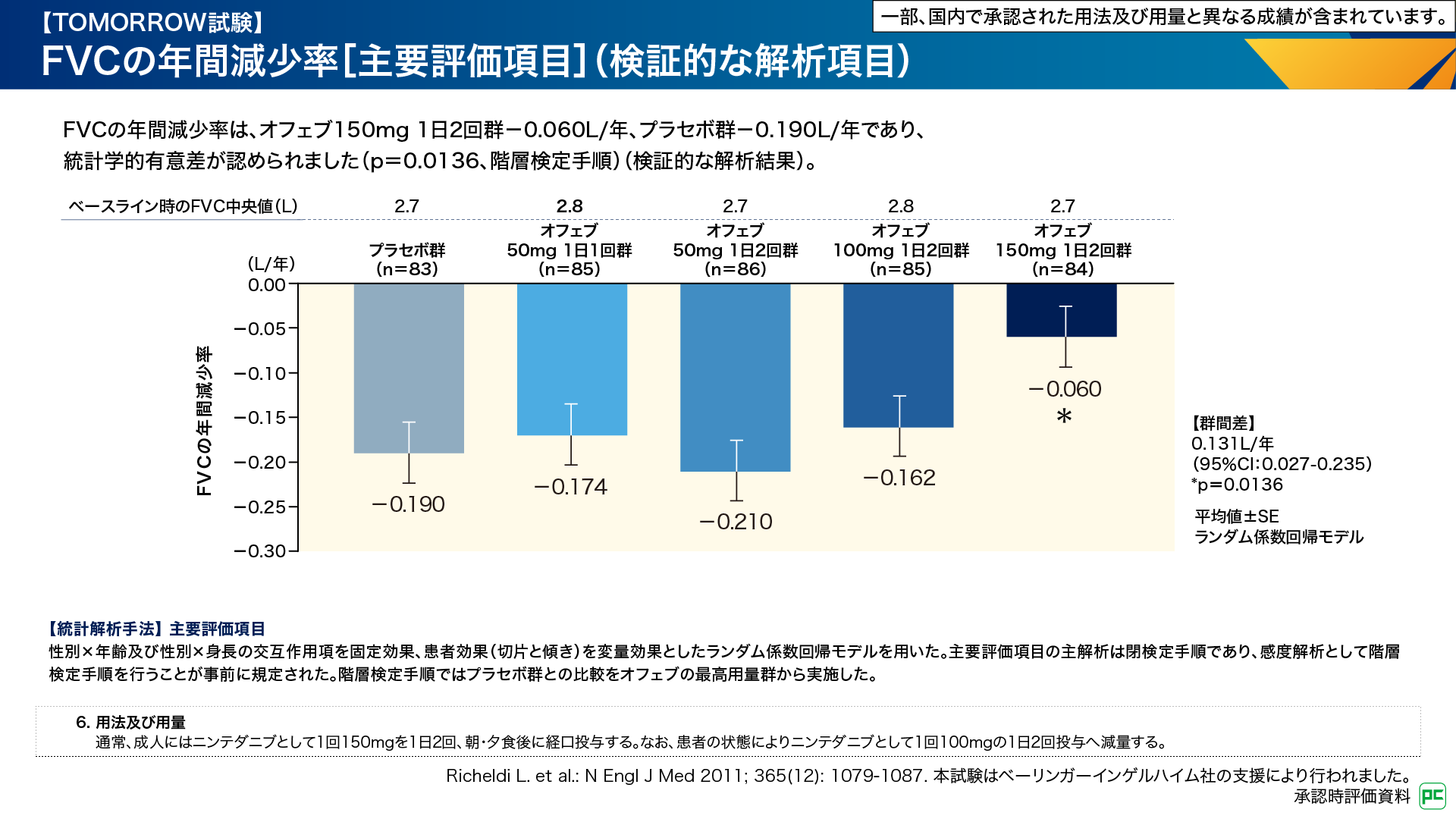
主要評価項目であるFVCの年間減少率は、オフェブ150mg 1日2回群-0.060L/年、プラセボ群-0.190L/年であり、オフェブ群はプラセボ群に対して呼吸機能の低下を有意に抑制することが検証されました(p=0.0136、階層検定手順)(図4)。その他の用法・用量群では有意差はありませんでした6,7)。
図4
副次評価項目である急性増悪発現率は、オフェブ150mg 1日2回群2.44/100人・年、プラセボ群15.67/100人・年であり、両群間に有意差が認められました(p=0.0150 名目上のp値、対数変換したリスク比の分布に正規分布を仮定して算出)(図5)。その他の用法・用量群では有意差はありませんでした6,7)。
図5
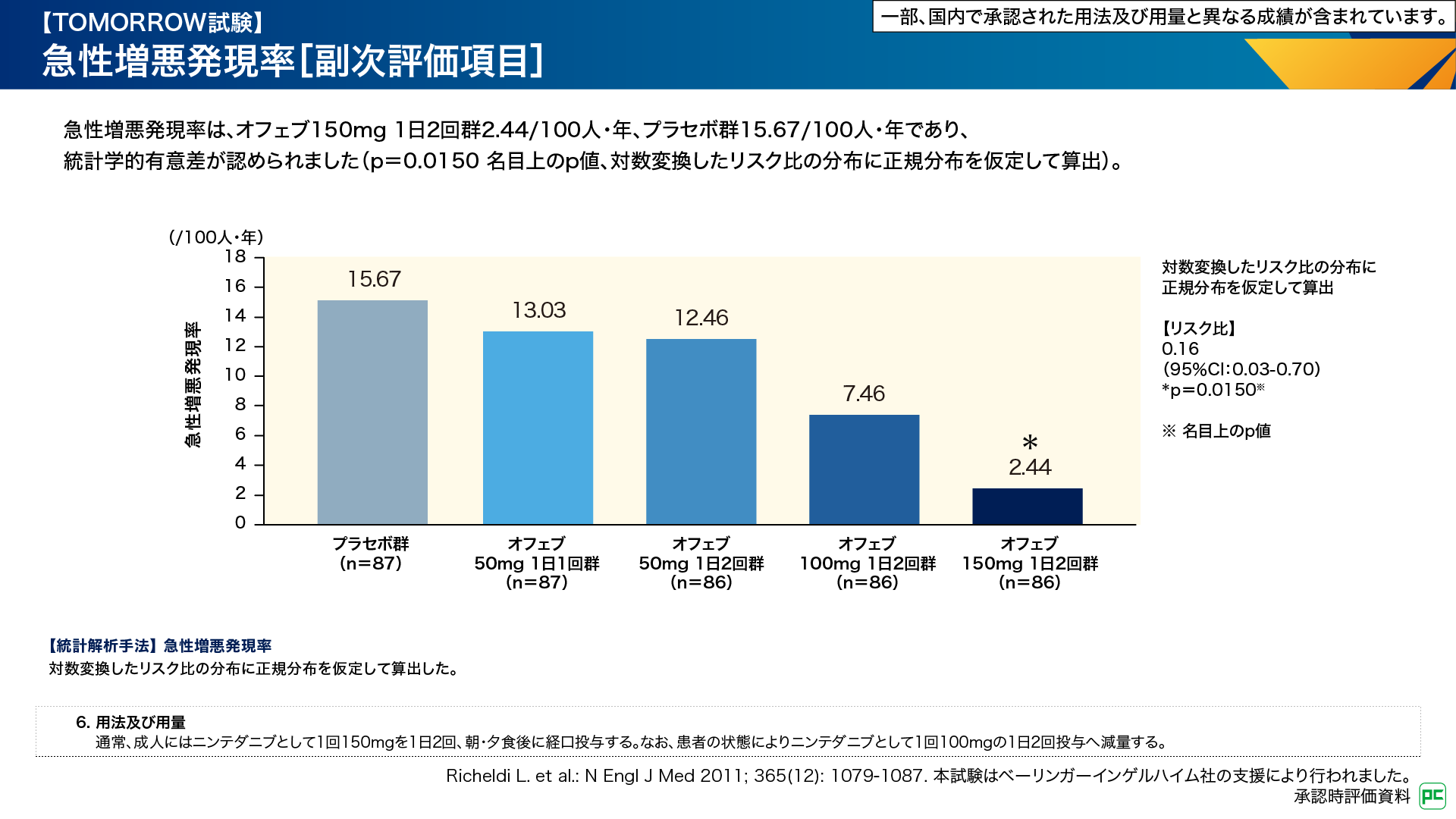
このように、FVCの年間減少率及び急性増悪発現率において、投与開始時のオフェブの投与量が150mg 1日2回の群でのみプラセボ群との間に有意差が認められました6,7)。この結果は、電子添文に記載されている用法及び用量(1回150mg 1日2回投与)で開始することが、患者さんのベネフィットにつながることを示しています。
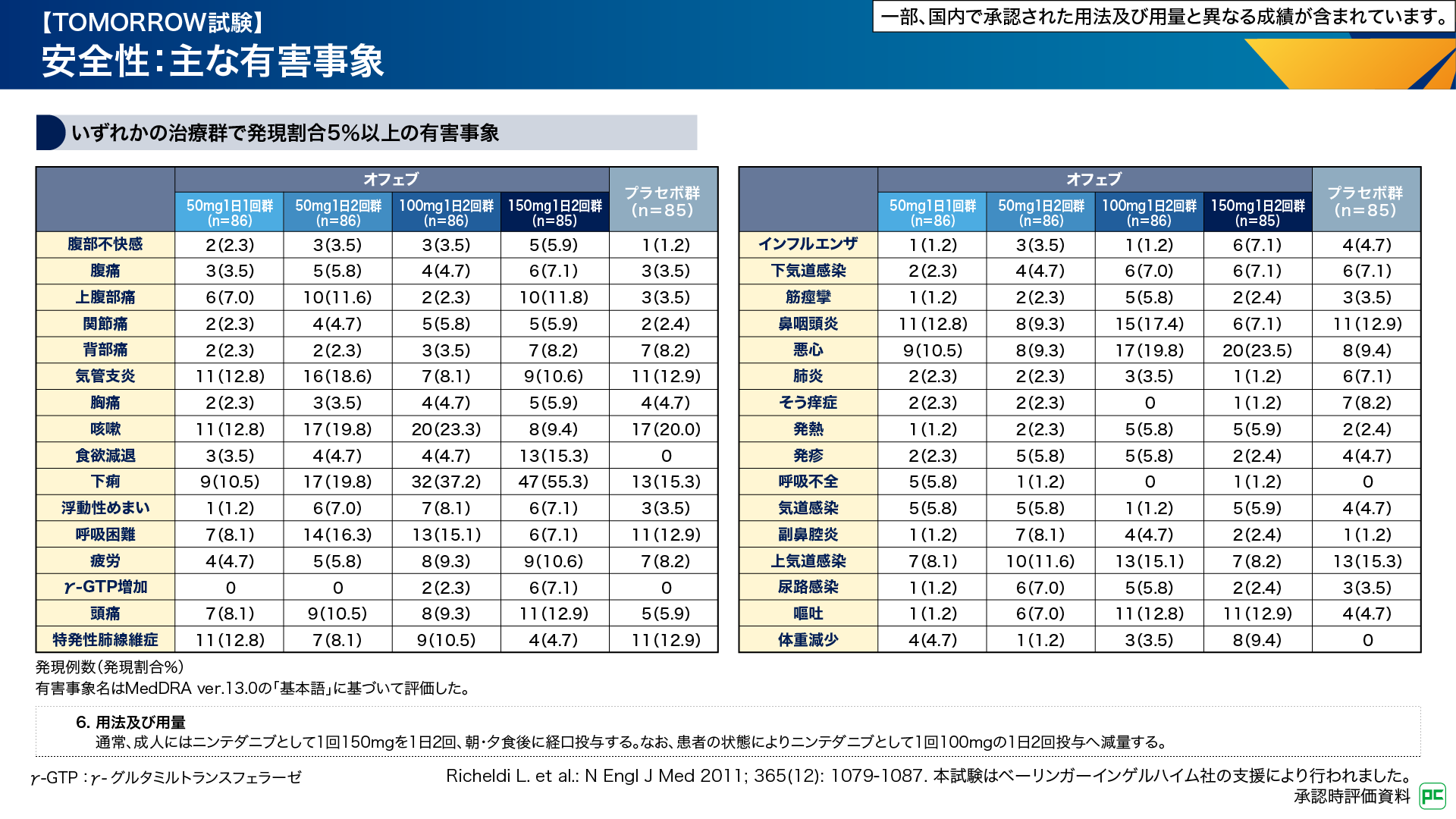
本試験での有害事象は、オフェブ50mg 1日1回群及び50mg 1日2回群で78例(90.7%)、100mg 1日2回群で82例(95.3%)、150mg 1日2回群で80例(94.1%)、プラセボ群で77例(90.6%)に認められました(図6)。重篤な有害事象、投与中止に至った有害事象、死亡に至った有害事象は図6のとおりです6,7)。
図6

主な有害事象はオフェブ50mg 1日1回群では気管支炎、咳嗽、特発性肺線維症、鼻咽頭炎が各11例(12.8%)、50mg 1日2回群では咳嗽、下痢が各17例(19.8%)、気管支炎16例(18.6%)、100mg 1日2回群では下痢32例(37.2%)、咳嗽20例(23.3%)、悪心17例(19.8%)、150mg 1日2回群では下痢47例(55.3%)、悪心20例(23.5%)、食欲減退13例(15.3%)、などでした(図7)6,7)。
図7
オフェブの血漿曝露量とFVC年間減少率の相関に関する解析
オフェブの血漿中濃度と有効性の関係という視点では、曝露-有効性モデルを用いた血漿曝露量とFVCの予測年間減少率の相関についての報告があります(図8)8)。
図8
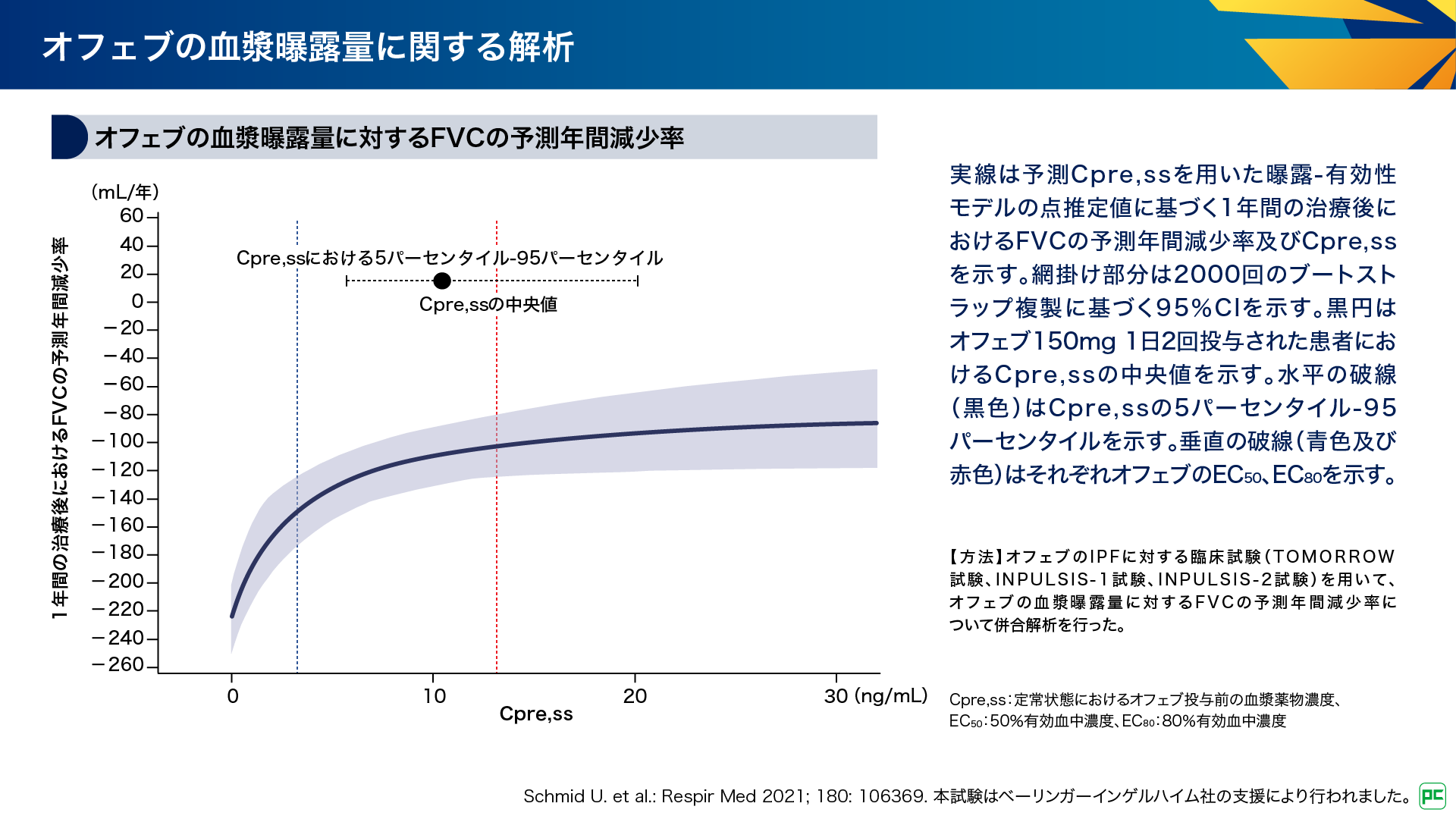
最大薬効のプラトーに近いEC80の推定値は10~13ng/mLであり(図中赤線)、オフェブ150mgを1日2回投与した際の、定常状態におけるオフェブ投与前の血漿薬物濃度(Cpre,ss)の中央値(10ng/mL、図中黒丸)と近い値でした8)。この結果は、推奨用量である150mg 1日2回により、有効な曝露レベルが達成されることを示しています8)。
オフェブ長期投与時における減量・休薬の影響:INPULSIS-ON試験
オフェブ投与中の用量調節の影響について、投与開始時の用量が150mg 1日2回に設定されたINPULSIS試験(図9)6,9)及びその延長試験であるINPULSIS-ON試験(図10)10)についてみていきましょう。
INPULSIS試験では、日本人126例を含むIPF患者さん1,066例をオフェブ群又はプラセボ群に3:2の比率でランダムに割り付け、試験薬を52週間投与しました6,9)。INPULSIS試験完遂後、4週間の追跡期間を完了した患者さんを対象として、オープンラベル延長試験INPULSIS-ON試験が行われました10)。
両試験とも、有害事象への対応として、試験参加医師の判断で中断及び/又は100mg 1日2回への減量、100mg 1日2回から150mg 1日2回への増量が許容されました6,9,10)。
図9

図10

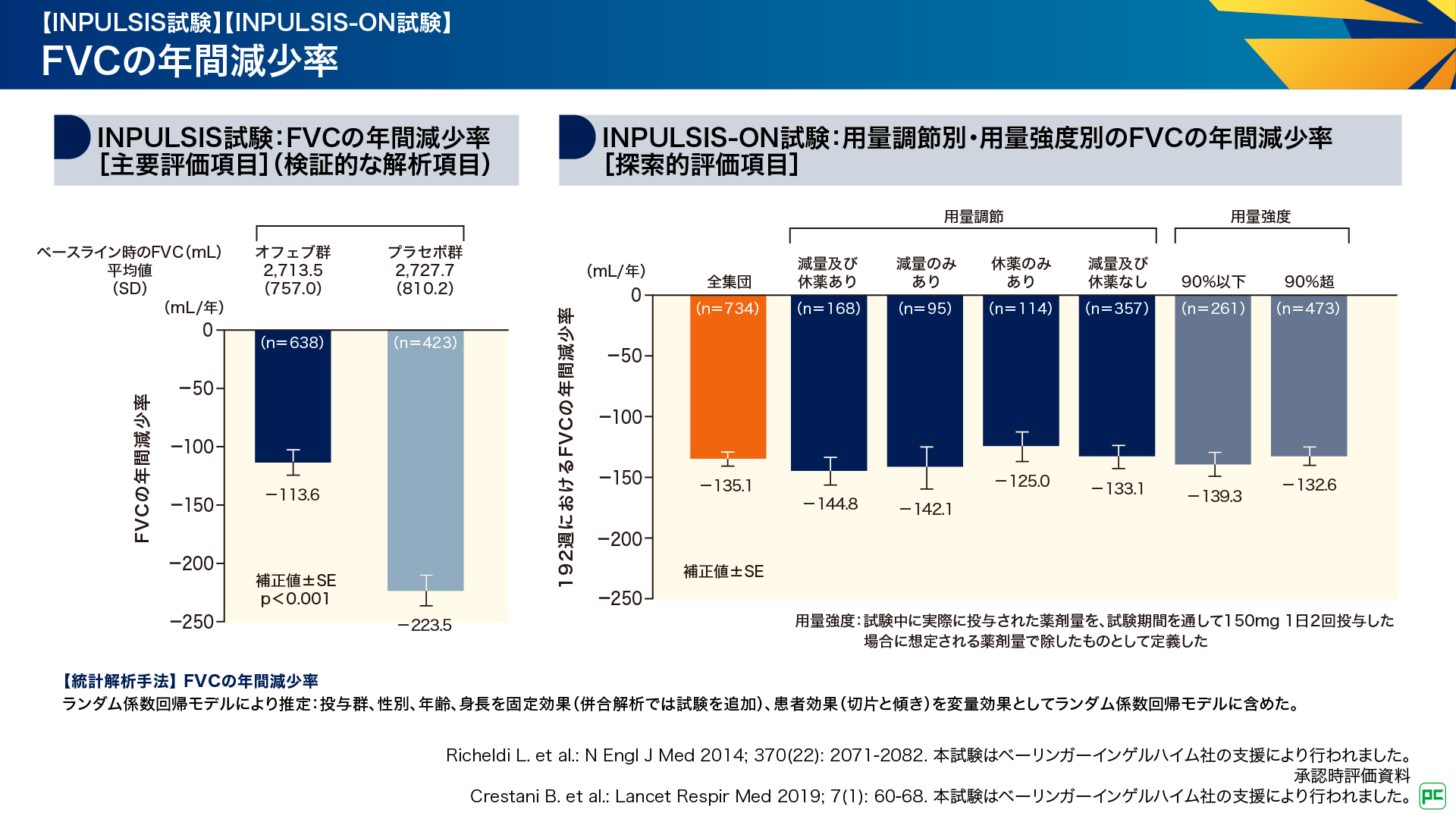
INPULSIS試験の主要評価項目である投与52週までのFVCの年間減少率は、オフェブ群-113.6mL/年、プラセボ群-223.5mL/年であり、オフェブ群はプラセボ群に対して呼吸機能の低下を有意に抑制することが検証されました(p<0.001、ランダム係数回帰モデル)(図11左)6,9)。INPULSIS-ON試験では、投与192週における用量調節の有無別、用量強度別のFVCの年間減少率が検討されました。全集団におけるFVCの年間減少率は-135.1mL/年でした。用量調節をした集団では、減量及び休薬あり群で-144.8mL/年、減量のみあり群で-142.1mL/年、休薬のみあり群で-125.0mL/年、減量及び休薬なし群で-133.1mL/年でした(図11右)10)。
図11
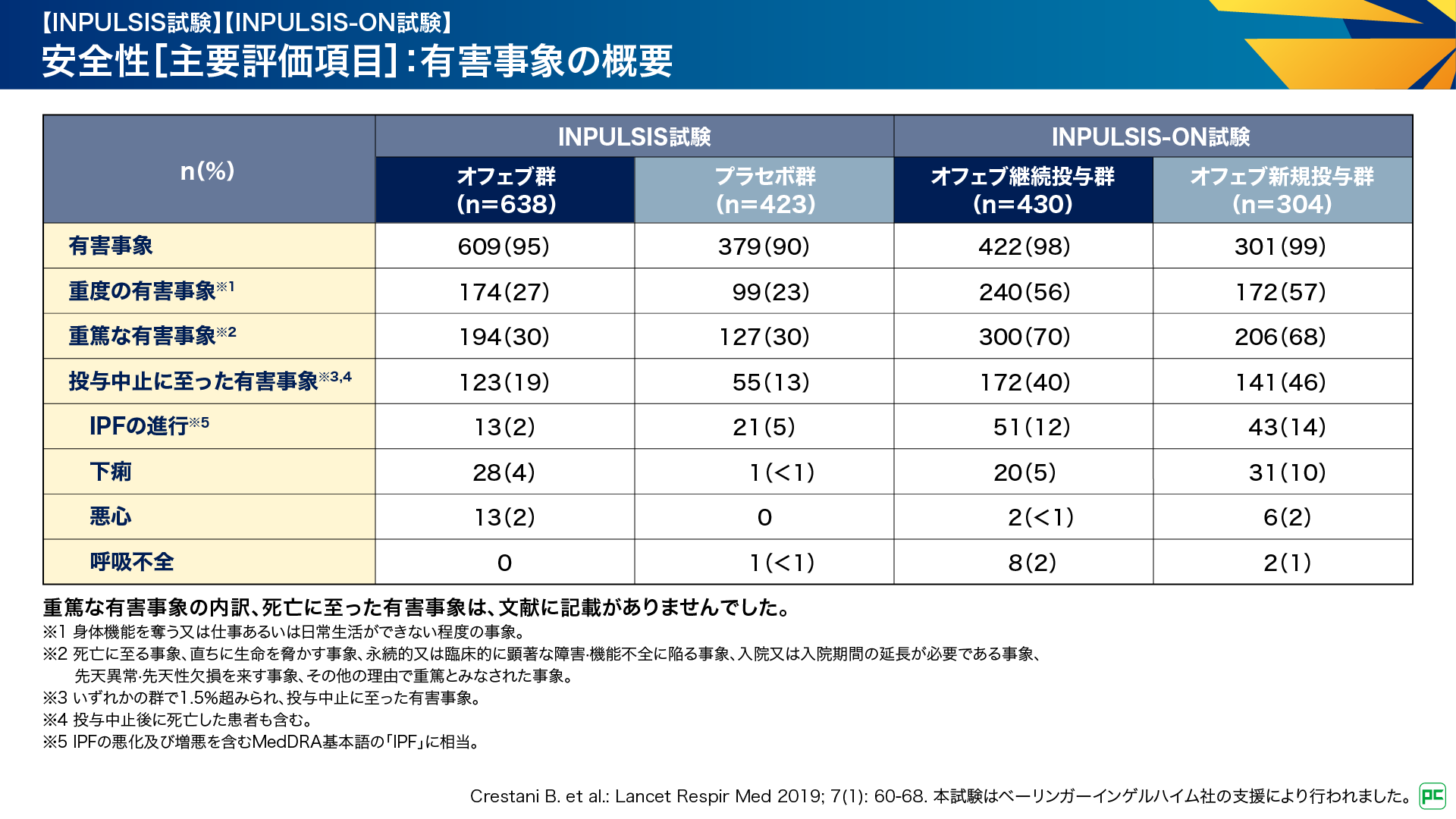
INPULSIS試験及びINPULSIS-ON試験の安全性の結果は図12のとおりです。INPULSIS試験における有害事象は、オフェブ群609例(95%)、プラセボ群379例(90%)に認められました6,9)。
INPULSIS-ON試験においては、オフェブ継続投与群422例(98%)、新規投与群301例(99%)に認められました。投与中止に至った有害事象はご覧のとおりです。なお、重篤な有害事象の内訳、死亡に至った有害事象は、文献に記載がありませんでした10)。
図12
このように、INPULSIS試験及び延長試験であるINPULSIS-ON試験では、150mg 1日2回で投与が開始され、有害事象に対して減量や休薬などの管理が行われました。減量や休薬の有無によるFVCの年間減少率への顕著な影響はみられなかったことから、適切な用量調節を行いながら治療を継続することが大切であると考えられます。
適正使用ガイドにおける下痢、悪心・嘔吐、肝機能障害に対する対処法
オフェブによる治療中に有害事象が発現した場合、治療継続のためにはどのように対応するべきでしょうか。ここでは、下痢、悪心・嘔吐、肝機能障害への対処法について、オフェブ適正使用ガイドの記載をみていきましょう11)。
下痢は、INPULSIS試験、SENSCIS試験(対象:SSc-ILD患者さん)及びINBUILD試験(対象:PF-ILD患者さん)のオフェブ群で最も頻度の高い副作用でした。
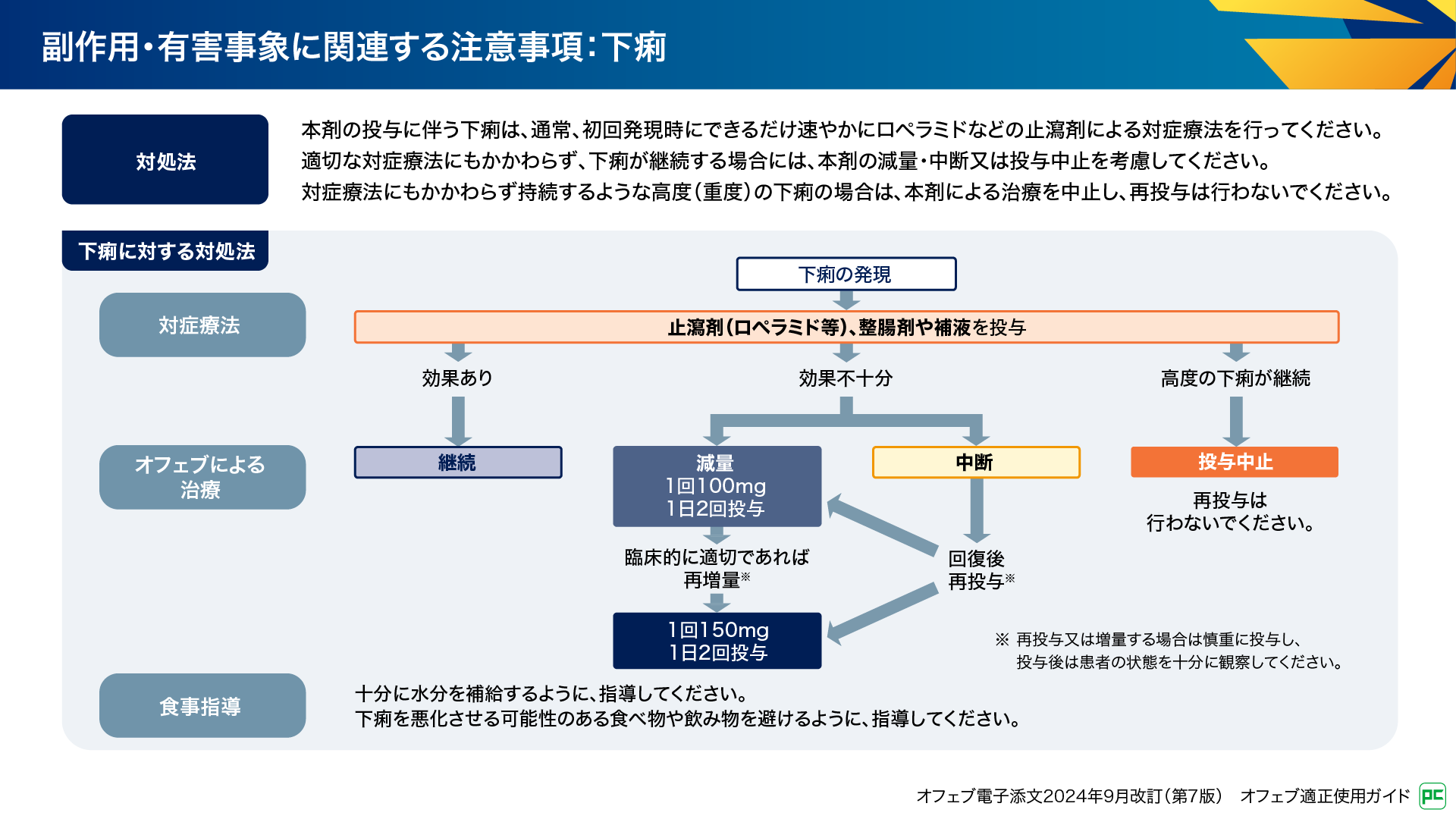
下痢の発現時には、速やかにロペラミドなどの止瀉剤、整腸剤、補液による対症療法を行います(図13)。適切な対症療法にもかかわらず効果不十分な場合は、管理フローに従って100mg 1日2回への減量又は中断を検討します。患者さんの状態をみながら、再投与や150mg 1日2回への増量を検討します。高度の下痢が継続する場合は投与を中止し再投与は行いません。また、水分補給や下痢を悪化させる食事を避けるように指導することも大切です11)。
図13
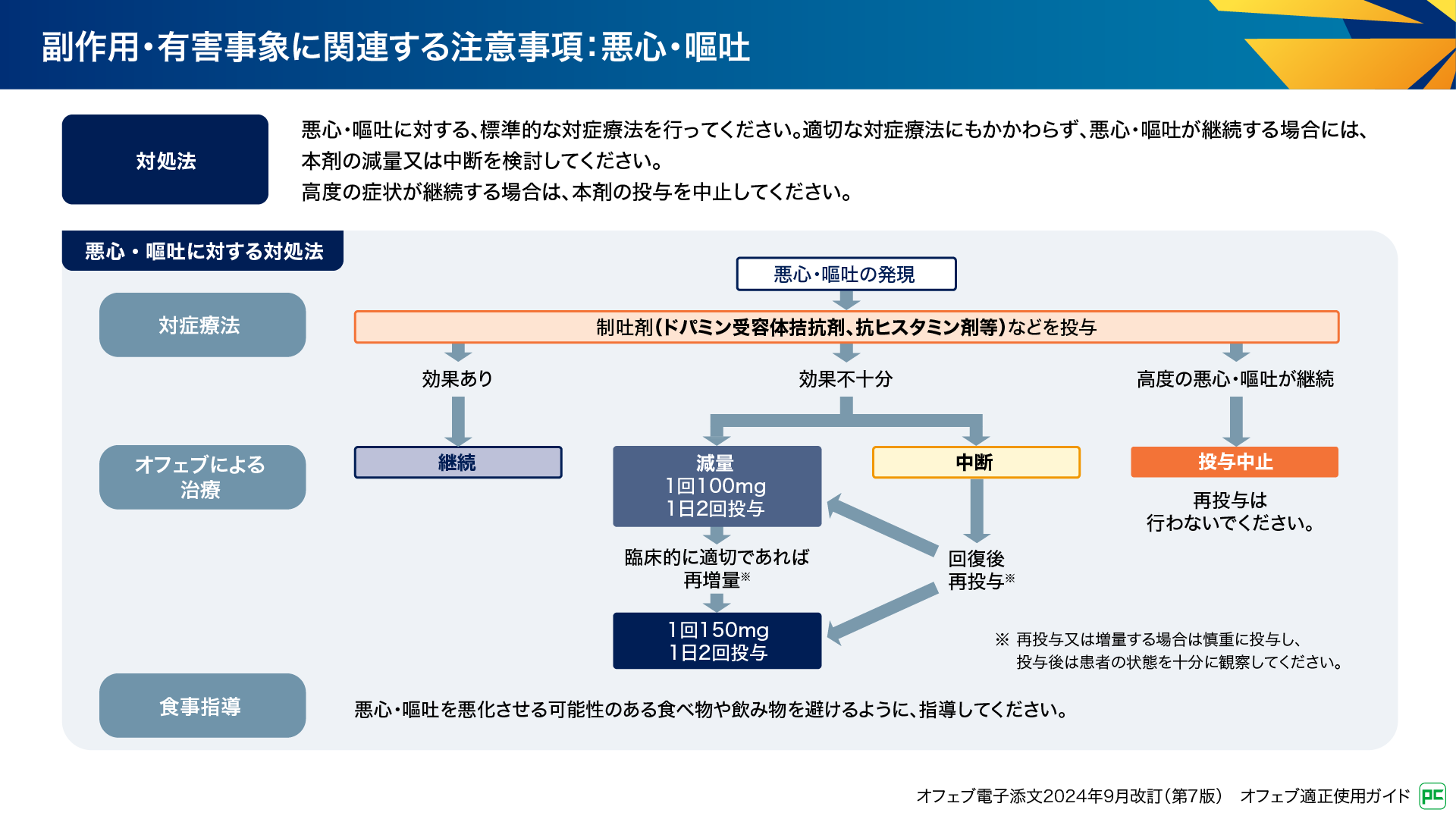
悪心・嘔吐の発現時には、制吐剤(ドパミン受容体拮抗剤、抗ヒスタミン剤等)などによる対症療法を行います(図14)。効果不十分な場合は、管理フローに従って減量又は中断を検討します。高度の悪心・嘔吐が継続する場合は投与を中止し再投与は行いません。また、悪心や嘔吐を悪化させる可能性のある食事を避けるように指導することも大切です11)。
図14
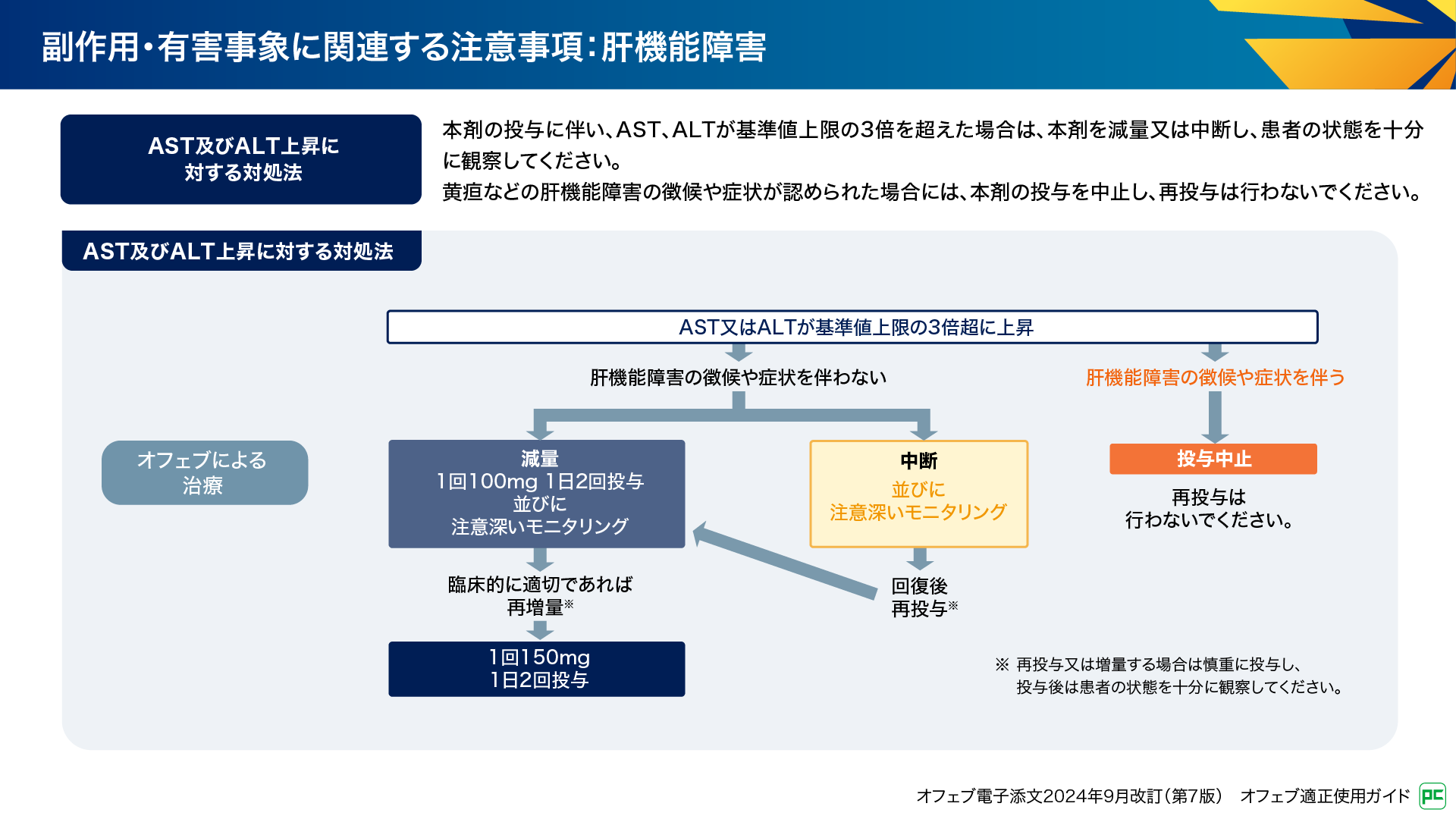
肝機能障害発現時の対処法を図15に示します。AST又はALTが基準値上限の3倍超に上昇し、黄疸などの肝機能障害の徴候や症状を伴わない場合には、管理フローに従って減量や中断などを検討します。肝機能障害の徴候や症状を伴う場合は、投与を中止し再投与は行いません11)。
図15
オフェブ適正使用ガイドには、ここで紹介した副作用以外にも、注目すべき副作用・有害事象に関する情報が記載されていますので、オフェブによる治療時には参照してください。
まとめ
オフェブによるPF-ILD治療では、関節リウマチ治療薬で一般的な「漸増」とは異なり、患者さんの状態に応じた「減量」による管理が求められます。
今回は、オフェブの用法及び用量の根拠を理解するために、IPF患者さんを対象とした試験をご紹介しましたが、用量調節に対する考え方はPF-ILDにおける治療においても同様です。TOMORROW試験(用量反応試験)やINPULSIS試験(開始用量:150mg 1日2回)では、有害事象に対して減量・休薬などの対応が行われました。また、統合解析では、長期投与における減量・休薬がFVCの年間減少率へ与える影響も検討されました。これらの結果から、治療開始用量や用量調節の意義を理解することが大切です。
オフェブによる治療では、電子添文に基づき「1回150mg 1日2回投与」から開始し、治療中は電子添文や適正使用ガイドを参考に、患者さんの状態を十分に確認しながら減量や中断などの適切な対応を行うことが、治療継続の鍵となります。今回ご紹介した内容を、先生方の日常診療にお役立ていただけますと幸いです。
図16

【参考文献】
- 日本呼吸器学会·日本リウマチ学会. 膠原病に伴う間質性肺疾患 診断・治療指針2020. p.103-113. 2020
- Nakajima A. et al.: Scand J Rheumatol 2010; 39(5): 360-367.
- Bongartz T. et al.: Arthritis Rheum 2010; 62(6): 1583-1591.
- オフェブ電子添文2024年9月改訂(第7版)
- 日本リウマチ学会MTX診療ガイドライン小委員会編. メトトレキサート(MTX)使用と診療の手引き2023年版.
- 承認時評価資料
- Richeldi L. et al.: N Engl J Med 2011; 365(12): 1079-1087. 本試験はベーリンガーインゲルハイム社の支援により行われました。
- Schmid U. et al.: Respir Med 2021; 180:106369. 本試験はベーリンガーインゲルハイム社の支援により行われました。
- Richeldi L. et al.: N Engl J Med 2014; 370(22): 2071-2082. 本試験はベーリンガーインゲルハイム社の支援により行われました。
- Crestani B. et al.: Lancet Respir Med 2019; 7(1): 60-68. 本試験はベーリンガーインゲルハイム社の支援により行われました。
- オフェブ適正使用ガイド
その他の関連情報


特発性間質性肺炎 診断と治療の手引き 2022 改訂第4版(静止画)
日本ベーリンガーインゲルハイム
メディカルチャット 利用規約
当社の「日本ベーリンガーインゲルハイム メディカルチャット」(以下「本サービス」といいます)のご利用に際しては、本利用規約が適用されますので、必ず以下の記載事項をご確認下さい。
利用規約
- 本サービスは、当社所定のウェブページから文字によりお問い合わせいただくことにより、当社医薬品等に関する一般的な情報を、人工知能あるいは当社担当者により、文字及び図表により回答するサービスです(以下、人工知能による回答サービスを「AIチャット」、当社担当者による回答サービスを「有人チャット」といいます。)。ただし、AIチャットによる回答を原則とし、有人チャットは、AIチャットでの回答に対し、有人チャットでの回答も希望された場合に、提供させていただきます。
- 本サービスをご利用いただくことができるのは、当社医薬品等を扱いかつ国内に在住する医療関係者の方に限られます。当該医療関係者以外の方は、ご利用いただくことができません。
- 本利用規約に同意いただけない場合、本サービスを利用いただくことができません。本利用規約を最後までお読みいただき、「同意して利用する」ボタンを押した上で、本サービスをご利用下さい。
- 本サービスは、当社医薬品等に関する一般的なお問い合わせに対して回答するものとし、次の各号に掲げるお問い合わせについては、回答しないものとします。
- 当社医薬品等と関係のないお問い合わせ、または本サービスの回答範囲を逸脱したお問い合わせ
- 具体的な症状や治療方法に関するお問合せ
- 当社に適用される法令、ガイドラインまたは行政上の指導、当社自主規制その他当社が遵守すべきルールにより回答できないお問い合わせ
- 文字化け等により入力内容が判断できないお問い合わせ
- 前各号に掲げるほか、本サービスにより、適切な回答をすることができないと当社が判断した事項に関するお問い合わせ
- 本サービスは、日本語のみに対応しています。
- 本サービスは、当社医薬品の副作用、不具合及び有害事象の報告を受け付けていません。
- お問い合わせの内容によっては、本サービスでは十分に回答できない場合もございます。予めご了承下さい。
- 本サービスの利用可能時間は、以下のとおりです。
- AIチャット
24時間365日 - 有人チャット
平日9:00~17:00
- AIチャット
- 前項に関わらず、メンテナンス及び障害等のため一時的に本サービスを中断する場合がございます。
本サービスのご利用の際には、原則として、個人情報(お名前、ご住所、電話番号、メールアドレス等)を入力しないようお願いします。ただし、AIチャット及び有人チャットを問わず、当社医薬品の適用外使用に関するお問い合わせについては、コンプライアンス上の理由により、当社より、氏名及び施設名の入力を求める場合がございます。この場合には、当社プライバシーポリシーの内容を確認いただき、同意いただける場合に限り、入力して下さい(プライバシーポリシーについては「VIII 利用規約、プライバシーポリシー」に記載のURLからアクセス下さい)。その他の場合に、当社より個人情報の入力を求めることは一切ございません。
- 当社医薬品のご使用にあたっては、最新の添付文書等をご確認下さい。
- 当社は、本サービスまたは本サービスにより提供される情報の利用に際し生じた結果については、一切責任を負いません。
本サービスの利用にあたり、以下の各号の行為を禁止します。
- 本サービスにより提供される情報を複製、複写、転載、改変等する行為
- 第三者または当社の知的財産権その他の権利を侵害する行為
- 第三者または当社を誹謗中傷し、または名誉・信用を毀損する行為
- 本サービスの利用による営利目的の行為
- 本サービスの運営又は他の利用者による本サービスの利用の妨げとなる行為
- 前各号のほか、当社が不適当であると判断する行為
当社は、いつでも本サービスの提供を終了、またはその内容を変更することができるものとします。
本サービスの利用に関しては、以下の利用規約及びプライバシーポリシーが併せて適用されますので、ご確認下さい。



