
慢性腎臓病治療で考慮すべき心不全管理の重要性とジャディアンスの臨床効果
サイトへ公開:2024年09月27日 (金)
クイックリンク
慢性腎臓病治療において心不全管理を考慮することの重要性と、ジャディアンスの有効性についてご紹介します。

先生はこのような患者さんに、心機能をどの程度考慮されますか?

先生の患者さんに、糖尿病はないものの、eGFR が40mL/min/1.73m2と低下している尿蛋白(1+)の慢性腎臓病(CKD)ステージがG3bの患者さんがいらっしゃった場合に、先生は心機能をどの程度考慮されるでしょうか?
CKDの予後改善には、心不全管理が重要です
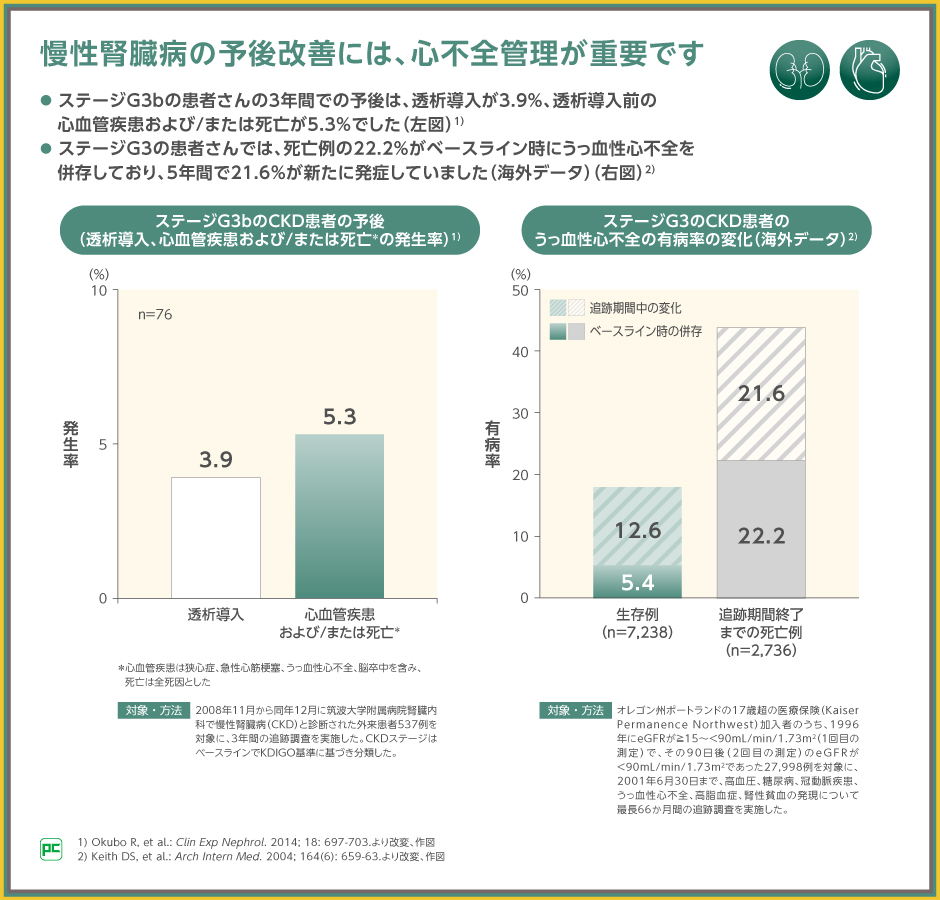
国内のCKD患者537例を対象とした3年間の追跡調査によると、ステージG3bの患者さんの3.9%が透析導入に至り、5.3%が透析導入前の心血管疾患および/または死亡に至りました。
また、CKD患者27,998例を対象とした追跡調査では、ステージG3の患者さんの死亡例において22.2%がベースライン時にうっ血性心不全を併存しており、追跡期間の5年間で21.6%が新たに発症し、併存率が倍近くとなっていたという報告もあることから、CKDの予後改善には心不全の管理が重要であると考えられます。
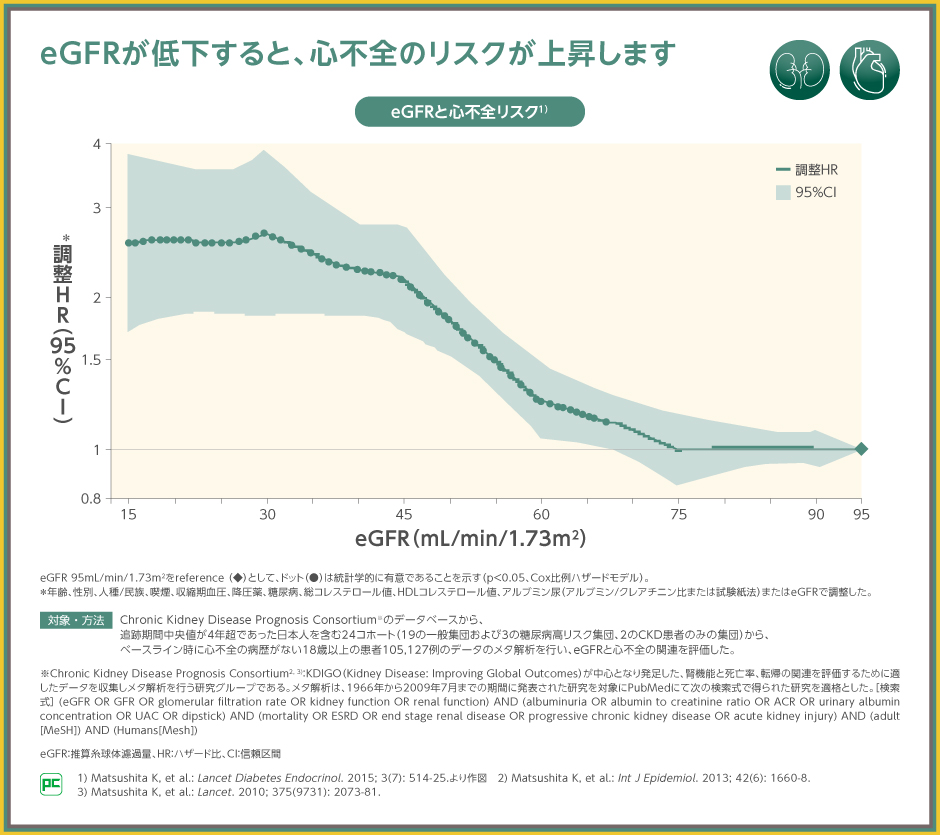
eGFRの低下は、心不全のリスク上昇と関連しています。
日本人を含む24コホートを対象とした、ベースライン時に心不全の病歴がない18歳以上の患者105,127例のデータを抽出して行ったメタ解析において、eGFR 95mL/min/1.73m2をreferenceとした時、75mL/min/1.73m2に低下すると心不全のハザード比が増加し始め、45mL/min/1.73m2まで低下すると2を超えることが示されました。
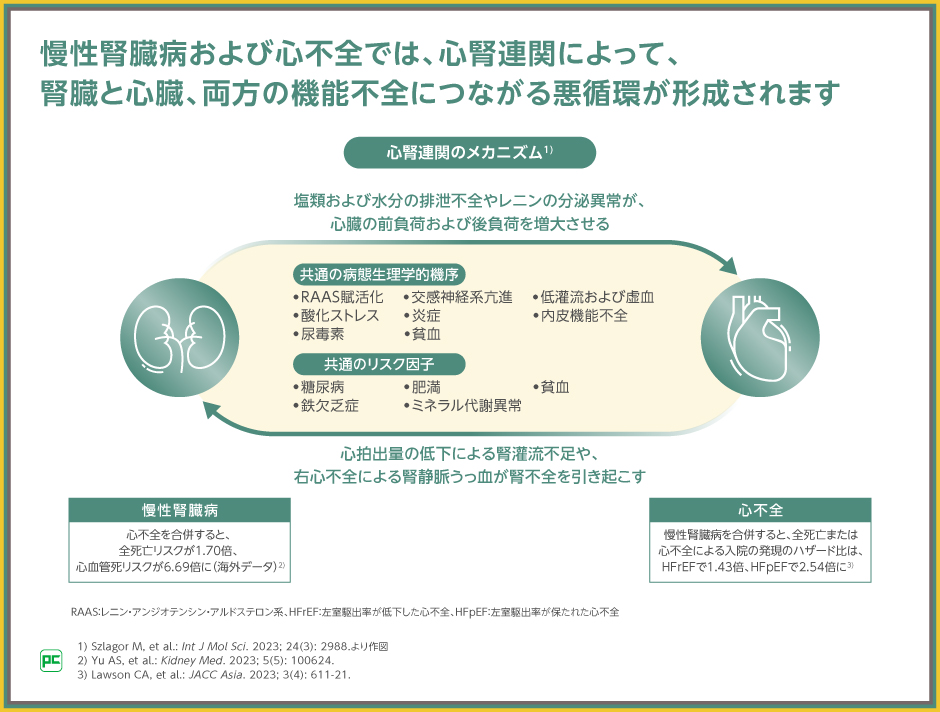
腎機能が心不全の予後に影響する理由として、心腎連関が挙げられます。
CKDと心不全は、病態生理学的な機序が共通している、疾患のリスク因子が共通しているといった特徴を有し、CKDの進展は心不全を悪化させ、心不全は腎機能低下を進行させると考えられます。
日本腎臓学会による「CKD診療ガイド2024」でも心腎連関について言及しており、腎機能障害や蛋白尿は心血管疾患や死亡の重大なリスク因子であり、CKD患者では心血管疾患の有無をスクリーニングする必要があり、集約的な治療戦略が必要であるとしています1)。
1) 日本腎臓学会編: CKD診療ガイド2024, 東京医学社, 2024, p24.
ジャディアンスのエビデンス①
腎疾患進行のリスクのあるCKD患者を対象とした国際共同第Ⅲ相・検証試験(EMPA-KIDNEY試験)

SGLT2阻害薬であるジャディアンスは、EMPA-KIDNEY試験で慢性腎臓病※に対する有効性が評価されました。
EMPA-KIDNEY試験では、CKD患者を対象として、ジャディアンス10mgを1日1回経口投与した時の有効性および安全性をプラセボ群と比較検討しました。
※ただし、末期腎不全又は透析施行中の患者を除く。

腎疾患進行または心血管死のリスクは、全体集団において、27%低下しました(HR=0.73、99.83%CI:0.59~0.89、p<0.0001、Cox回帰モデル)(検証的な解析結果)。この主要評価項目に対して事前規定されたサブグループ解析として行われた心血管疾患の病歴別の解析では、病歴なしおよび病歴ありにおいて、それぞれHR=0.73(95%CI:0.63~0.85)およびHR=0.73(95%CI:0.58~0.93)でした。
日本人集団の解析ではHR=0.44(95%CI:0.28~0.69)、病歴別では、病歴なしおよび病歴ありにおいて、それぞれHR=0.50(95%CI:0.30~0.81)およびHR=0.19(95%CI:0.04~0.84)でした。
また、全体集団でのeGFRスロープ(mL/min/1.73m2/年)は、ベースラインから最終フォローアップ来院まで(全期間)において、プラセボ群-2.90に対してジャディアンス10mg群-2.16、2ヵ月目の来院から最終フォローアップ来院まで(慢性期)において、プラセボ群-2.74に対してジャディアンス10mg群-1.37であり、いずれもジャディアンス10mg群はプラセボ群に対してeGFRスロープの低下が小さかったことが示されました(いずれもp<0.0001、名目上のp値、shared parameterモデル)。
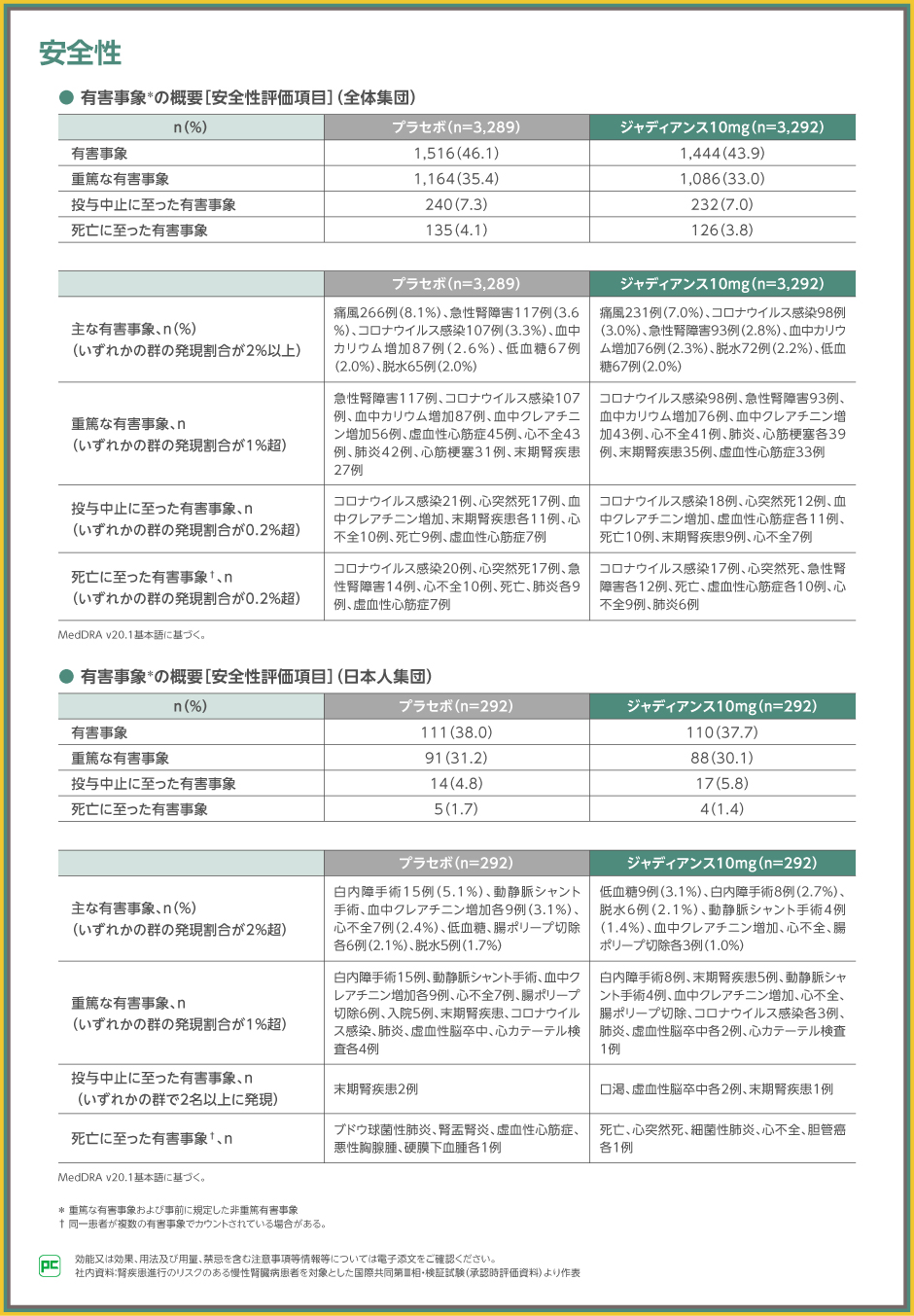
EMPA-KIDNEY試験の安全性については、事前に規定した非重篤有害事象および全ての重篤な有害事象に限定して有害事象を収集した結果、それらの全体集団における発現割合は、ジャディアンス10mg群で43.9%(1,444/3,292例)、プラセボ群で46.1%(1,516/3,289例)でした。
主な有害事象は、ジャディアンス10mg群で痛風231例(7.0%)、コロナウイルス感染98例(3.0%)、急性腎障害93例(2.8%)等、プラセボ群で痛風266例(8.1%)、急性腎障害117例(3.6%)、コロナウイルス感染107例(3.3%)等でした。また、重篤な有害事象は、ジャディアンス10mg群でコロナウイルス感染98例、急性腎障害93例、血中カリウム増加76例等、プラセボ群で急性腎障害117例、コロナウイルス感染107例、血中カリウム増加87例等でした。投与中止、死亡に至った有害事象は表の通りでした。
ジャディアンスのエビデンス②
左室駆出率が低下した(LVEF≦40%)慢性心不全患者を対象とした国際共同第Ⅲ相・検証試験
(EMPEROR-Reduced試験)および
左室駆出率が保たれた(LVEF>40%)慢性心不全患者を対象とした国際共同第Ⅲ相・検証試験
(EMPEROR-Preserved試験)

ジャディアンスでは、LVEF≦40%の心不全患者を対象としたEMPEROR-Reduced試験とLVEF>40%の心不全患者を対象としたEMPEROR-Preserved試験にて、ジャディアンス10mgを1日1回経口投与した時の慢性心不全患者における有効性および安全性についてプラセボ群との比較検討を行いました。
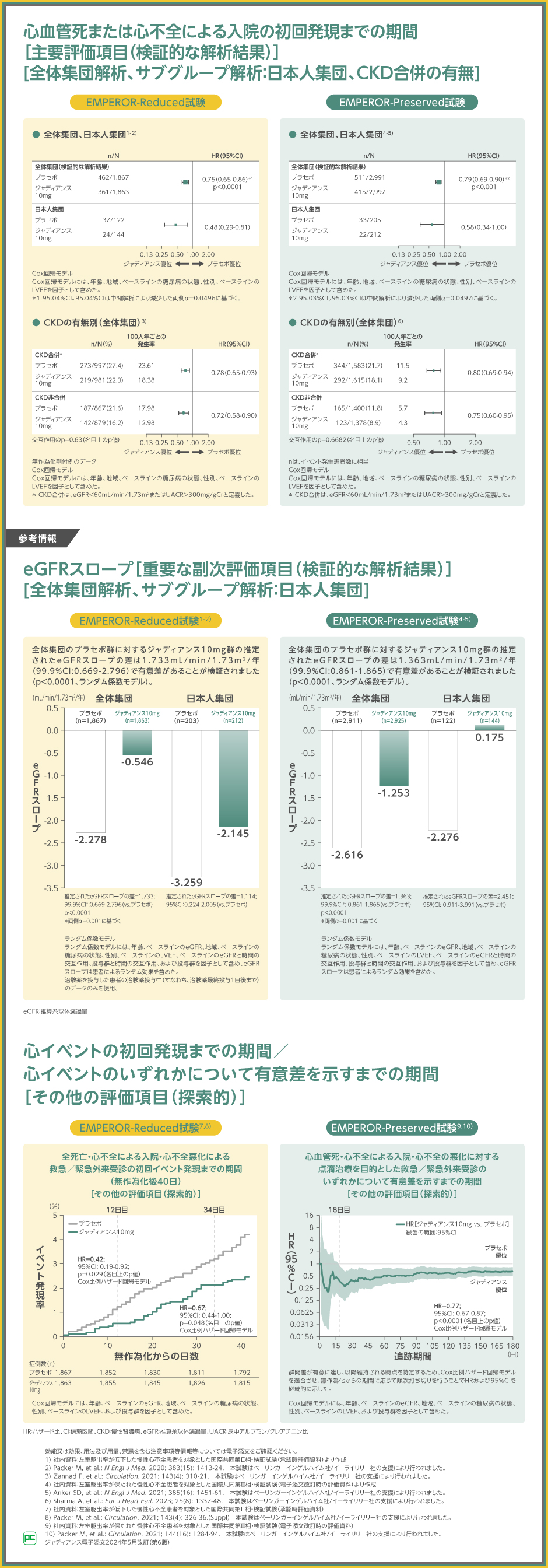
EMPEROR-Reduced試験では、全体集団における、心血管死または心不全による入院の初回発現までの期間のプラセボ群に対するジャディアンス10mg群のハザード比は0.75(95.04%CI:0.65~0.86)、p<0.0001(Cox比例ハザード回帰モデル)であり、ジャディアンス10mg群の優越性が検証されました。日本人集団でのプラセボ群に対するジャディアンス10mg群のハザード比は0.48(95%CI:0.29~0.81)でした。さらに、CKD合併の有無別に事前規定したサブグループ解析を行った結果、CKD合併でのプラセボ群に対するジャディアンス10mg群のハザード比は0.78(95%CI:0.65~0.93)、CKD非合併でのプラセボ群に対するジャディアンス10mg群のハザード比は0.72(95%CI:0.58~0.90)(交互作用のp値:0.63、名目上のp値)でした。
EMPEROR-Preserved試験では、全体集団における、心血管死または心不全による入院の初回発現までの期間のプラセボ群に対するジャディアンス10mg群のハザード比は0.79(95.03%CI:0.69~0.90)、p<0.001(Cox比例ハザード回帰モデル)であり、ジャディアンス10mg群の優越性が検証されました。日本人集団でのプラセボ群に対するジャディアンス10mg群のハザード比は0.58(95%CI:0.34~1.00)でした。CKD合併でのプラセボ群に対するジャディアンス10mg群のハザード比は0.80(95%CI:0.69~0.94)、CKD非合併でのプラセボ群に対するジャディアンス10mg群のハザード比は0.75(95%CI:0.60~0.95)(交互作用のp値:0.6682、名目上のp値)でした。
【参考情報】
EMPEROR-Reduced試験では、腎機能への影響を示すeGFRスロープは、全体集団においてジャディアンス10mg群で-0.546mL/min/1.73m2/年、プラセボ群で-2.278 mL/min/1.73m2/年であり、ジャディアンス10mg群とプラセボ群の差は1.733mL/min/1.73m2/年でした。
EMPEROR-Preserved試験におけるeGFRスロープは、全体集団においてジャディアンス10mg群で-1.253mL/min/1.73m2/年、プラセボ群で-2.616mL/min/1.73m2/年であり、ジャディアンス10mg群とプラセボ群の差は1.363mL/min/1.73m2/年でした。
また、ジャディアンスが有効性を示すまでの期間を検討するために行った解析では、EMPEROR-Reduced試験において、全死亡・心不全による入院・心不全悪化による救急/緊急外来受診の初回イベント発現までの期間(無作為化後40日)のプラセボ群に対するジャディアンス10mg群のハザード比は、無作為化後12日目において0.42(95%CI:0.19~0.92)、p=0.029(Cox比例ハザード回帰モデル、名目上のp値)でした。EMPEROR-Preserved試験において、心血管死・心不全による入院・心不全の悪化に対する点滴治療を目的とした救急/緊急外来受診のいずれかについて有意差を示すまでの期間のプラセボ群に対するジャディアンス10mg群のハザード比は、追跡期間18日目において0.77(95%CI:0.67~0.87)、p<0.0001(Cox比例ハザード回帰モデル、名目上のp値)でした。
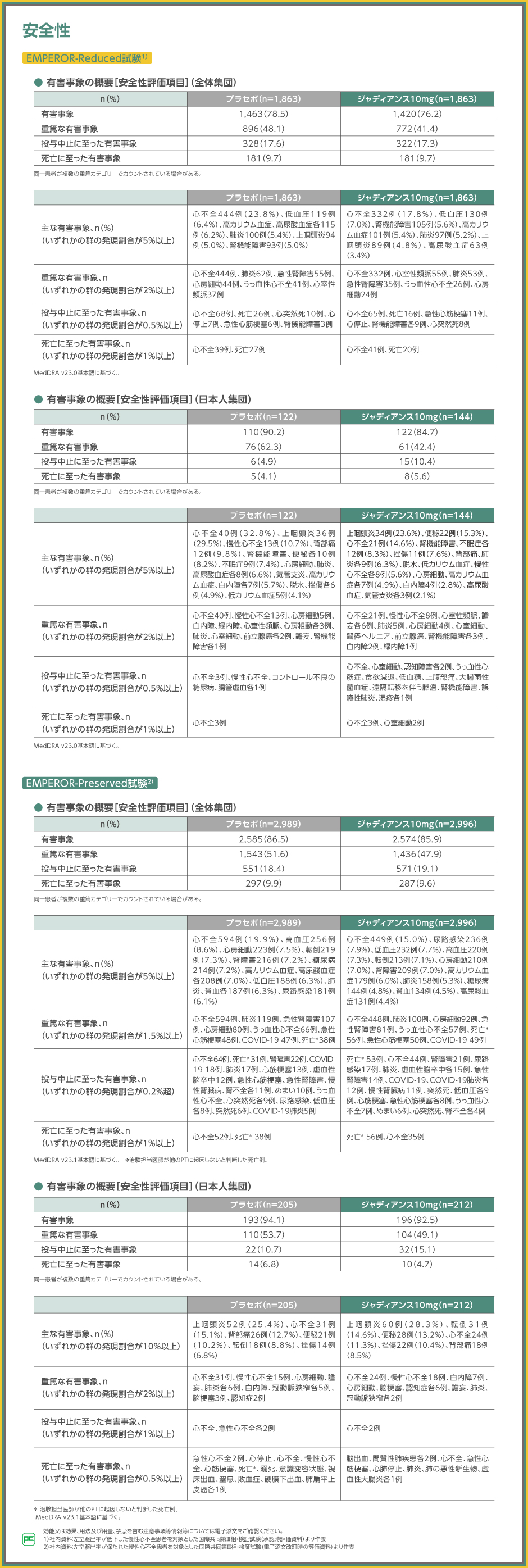
EMPEROR-Reduced試験の安全性については、全体集団での有害事象の発現割合が、ジャディアンス10mg群で76.2%(1,420/1,863例)、プラセボ群で78.5%(1,463/1,863例)でした。
主な有害事象は、ジャディアンス10mg群で心不全332例(17.8%)、低血圧130例(7.0%)、腎機能障害105例(5.6%)等、プラセボ群で心不全444例(23.8%)、低血圧119例(6.4%)、高カリウム血症、高尿酸血症各115例(6.2%)等でした。重篤な有害事象は、ジャディアンス10mg群で心不全332例、心室性頻脈55例、肺炎53例等、プラセボ群で心不全444例、肺炎62例、急性腎障害55例等でした。なお、投与中止、死亡に至った有害事象は表の通りでした。
EMPEROR-Preserved試験の安全性については、全体集団での有害事象の発現割合が、ジャディアンス10mg群で85.9%(2,574/2,996例)、プラセボ群で86.5%(2,585/2,989例)でした。
主な有害事象は、ジャディアンス10mg群で心不全449例(15.0%)、尿路感染236例(7.9%)、低血圧232例(7.7%)等、プラセボ群で心不全594例(19.9%)、高血圧256例(8.6%)、心房細動223例(7.5%)等でした。重篤な有害事象は、ジャディアンス10mg群で心不全448例、肺炎100例、心房細動92例、急性腎障害81例等、プラセボ群で心不全594例、肺炎119例、急性腎障害107例等でした。なお、投与中止、死亡に至った有害事象は表の通りでした。
心不全を考慮した慢性腎臓病※1治療にジャディアンス10 mgをお役立てください
※1 ただし、末期腎不全又は透析施行中の患者を除く。

ジャディアンスは1日1回10mgで慢性腎臓病※1、慢性心不全※2、2型糖尿病※3に対して投与することが可能です。
慢性腎臓病※1と慢性心不全※2に対するジャディアンスの用法及び用量は1日1回10mgの経口投与です。朝食前または朝食後のどちらでも服用可能です。
図に示すような年齢75歳のCKD患者の治療においては、透析などの末期腎不全を見据えた治療だけでなく、心不全の管理を考慮したCKD治療が重要であると考えられます。
ジャディアンスは、CKD患者における腎疾患進行または心血管死のリスクに対する影響について、臨床試験によるエビデンスが示されています。
また、慢性心不全に対してもエビデンスを有しており、左室駆出率を問わず慢性心不全※2に処方可能です。
CKD患者に対する心腎連関および心不全を考慮した慢性腎臓病※1治療として、ジャディアンス錠10mgをお役立てください。
※1 ただし、末期腎不全又は透析施行中の患者を除く。
※2 ただし、慢性心不全の標準的な治療を受けている患者に限る。
※3 2型糖尿病の患者では、効果不十分な場合には、経過を十分に観察しながら25mg1日1回に増量することができる。
その他の関連情報


疫学とエビデンスでみる 日本人におけるCKD治療
日本ベーリンガーインゲルハイム
メディカルチャット 利用規約
当社の「日本ベーリンガーインゲルハイム メディカルチャット」(以下「本サービス」といいます)のご利用に際しては、本利用規約が適用されますので、必ず以下の記載事項をご確認下さい。
利用規約
- 本サービスは、当社所定のウェブページから文字によりお問い合わせいただくことにより、当社医薬品等に関する一般的な情報を、人工知能あるいは当社担当者により、文字及び図表により回答するサービスです(以下、人工知能による回答サービスを「AIチャット」、当社担当者による回答サービスを「有人チャット」といいます。)。ただし、AIチャットによる回答を原則とし、有人チャットは、AIチャットでの回答に対し、有人チャットでの回答も希望された場合に、提供させていただきます。
- 本サービスをご利用いただくことができるのは、当社医薬品等を扱いかつ国内に在住する医療関係者の方に限られます。当該医療関係者以外の方は、ご利用いただくことができません。
- 本利用規約に同意いただけない場合、本サービスを利用いただくことができません。本利用規約を最後までお読みいただき、「同意して利用する」ボタンを押した上で、本サービスをご利用下さい。
- 本サービスは、当社医薬品等に関する一般的なお問い合わせに対して回答するものとし、次の各号に掲げるお問い合わせについては、回答しないものとします。
- 当社医薬品等と関係のないお問い合わせ、または本サービスの回答範囲を逸脱したお問い合わせ
- 具体的な症状や治療方法に関するお問合せ
- 当社に適用される法令、ガイドラインまたは行政上の指導、当社自主規制その他当社が遵守すべきルールにより回答できないお問い合わせ
- 文字化け等により入力内容が判断できないお問い合わせ
- 前各号に掲げるほか、本サービスにより、適切な回答をすることができないと当社が判断した事項に関するお問い合わせ
- 本サービスは、日本語のみに対応しています。
- 本サービスは、当社医薬品の副作用、不具合及び有害事象の報告を受け付けていません。
- お問い合わせの内容によっては、本サービスでは十分に回答できない場合もございます。予めご了承下さい。
- 本サービスの利用可能時間は、以下のとおりです。
- AIチャット
24時間365日 - 有人チャット
平日9:00~17:00
- AIチャット
- 前項に関わらず、メンテナンス及び障害等のため一時的に本サービスを中断する場合がございます。
本サービスのご利用の際には、原則として、個人情報(お名前、ご住所、電話番号、メールアドレス等)を入力しないようお願いします。ただし、AIチャット及び有人チャットを問わず、当社医薬品の適用外使用に関するお問い合わせについては、コンプライアンス上の理由により、当社より、氏名及び施設名の入力を求める場合がございます。この場合には、当社プライバシーポリシーの内容を確認いただき、同意いただける場合に限り、入力して下さい(プライバシーポリシーについては「VIII 利用規約、プライバシーポリシー」に記載のURLからアクセス下さい)。その他の場合に、当社より個人情報の入力を求めることは一切ございません。
- 当社医薬品のご使用にあたっては、最新の添付文書等をご確認下さい。
- 当社は、本サービスまたは本サービスにより提供される情報の利用に際し生じた結果については、一切責任を負いません。
本サービスの利用にあたり、以下の各号の行為を禁止します。
- 本サービスにより提供される情報を複製、複写、転載、改変等する行為
- 第三者または当社の知的財産権その他の権利を侵害する行為
- 第三者または当社を誹謗中傷し、または名誉・信用を毀損する行為
- 本サービスの利用による営利目的の行為
- 本サービスの運営又は他の利用者による本サービスの利用の妨げとなる行為
- 前各号のほか、当社が不適当であると判断する行為
当社は、いつでも本サービスの提供を終了、またはその内容を変更することができるものとします。
本サービスの利用に関しては、以下の利用規約及びプライバシーポリシーが併せて適用されますので、ご確認下さい。



