
高齢者2型糖尿病の心腎代謝連関を考慮した治療アプローチとジャディアンス
サイトへ公開:2023年12月20日 (水)
クイックリンク

高齢者糖尿病の特徴
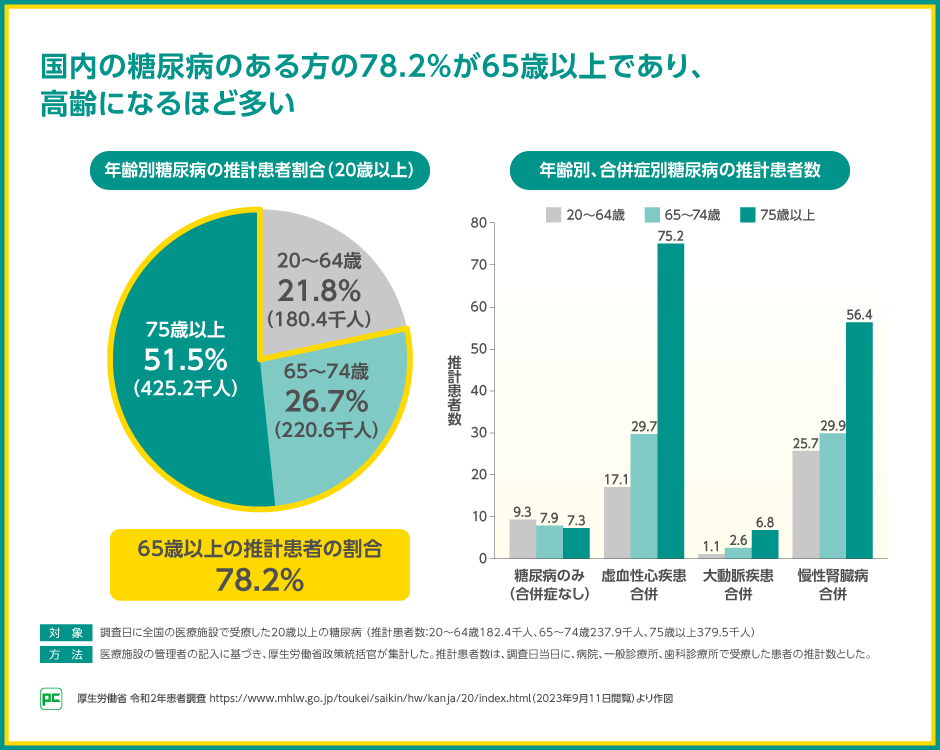
超高齢社会である日本では、成人の糖尿病のある方のうち、78.2%が65歳以上であると推定されることが令和5年の患者調査で報告されました。
また、同患者調査では、年齢が上がるほど、糖尿病と心血管疾患や腎疾患を合併する方が多いことが示されました。
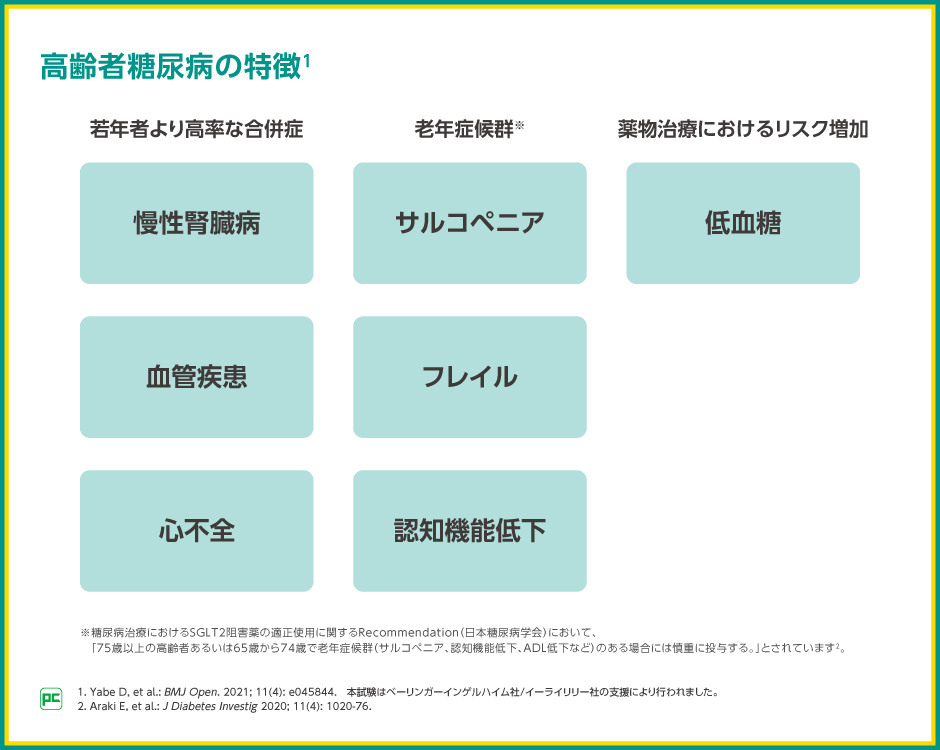
このように高齢者糖尿病には、老年症候群や薬物治療による低血糖リスクの増加だけでなく、若年者と比べて血管疾患、心不全、慢性腎臓病といった心腎合併症が高率に発現するという特徴があります。
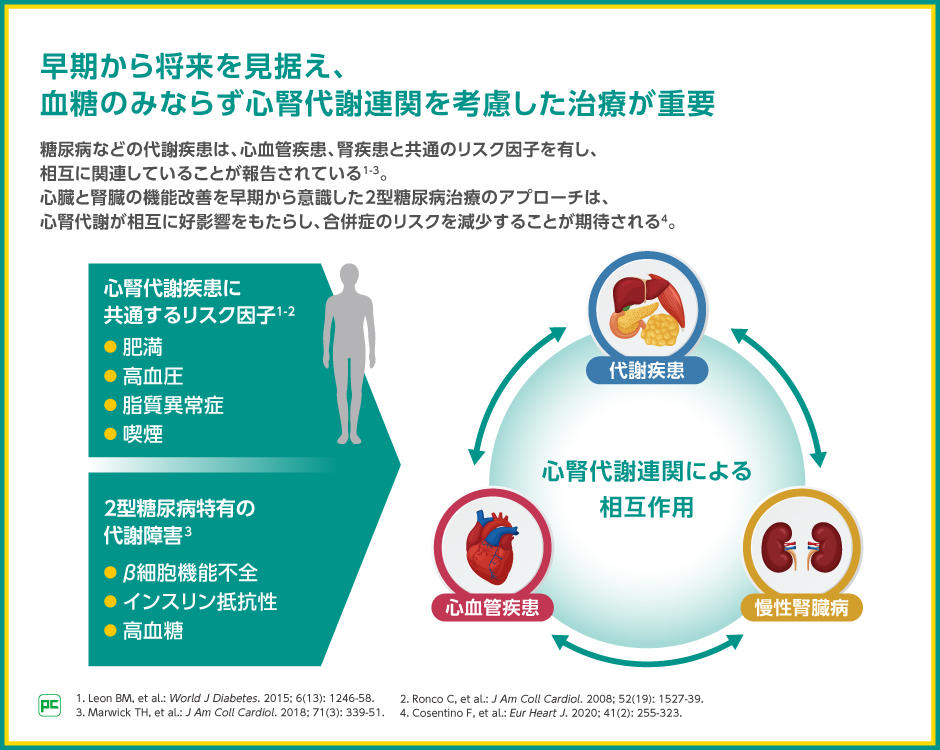
糖尿病とそれに伴う心腎合併症は肥満や高血圧など共通のリスク因子を有しており、相互に関連していることが知られています。
高齢者糖尿病では、この心腎代謝連関を踏まえ、腎機能への影響を考慮した2型糖尿病治療を行うことで、合併症のリスクを抑えることが重要です。
高齢者におけるジャディアンスのエビデンス:EMPA-ELDERLY試験

高齢者糖尿病に対するSGLT2阻害薬の影響を検討するため、国内18施設において、65歳以上の高齢者2型糖尿病129例を対象としてプラセボ対照無作為化二重盲検比較試験のEMPA-ELDERLY試験が行われました。
本試験は、糖尿病基礎治療に加えてジャディアンス10mgまたはプラセボを52週投与し、主要評価項目としてHbA1cのベースラインからの変化量、副次評価項目として体組成、握力、5回椅子立ち上がりテストの所要時間のベースラインからの変化量、統計解析計画書での事前規定項目として体重のベースラインからの変化量について、検討しました。

参加者の平均年齢はジャディアンス10mg群で74.2歳、プラセボ群で74.0歳、平均HbA1cは両群とも7.6%でした。平均BMIはジャディアンス10mg群で25.7 kg/m2、プラセボ群で25.4 kg/m2、平均eGFRはそれぞれ81.9 mL/分/1.73m2、79.1 mL/分/1.73m2でした。糖尿病に対する基礎治療としてはDPP-4阻害薬、ビグアナイド薬が多く使用されていました。
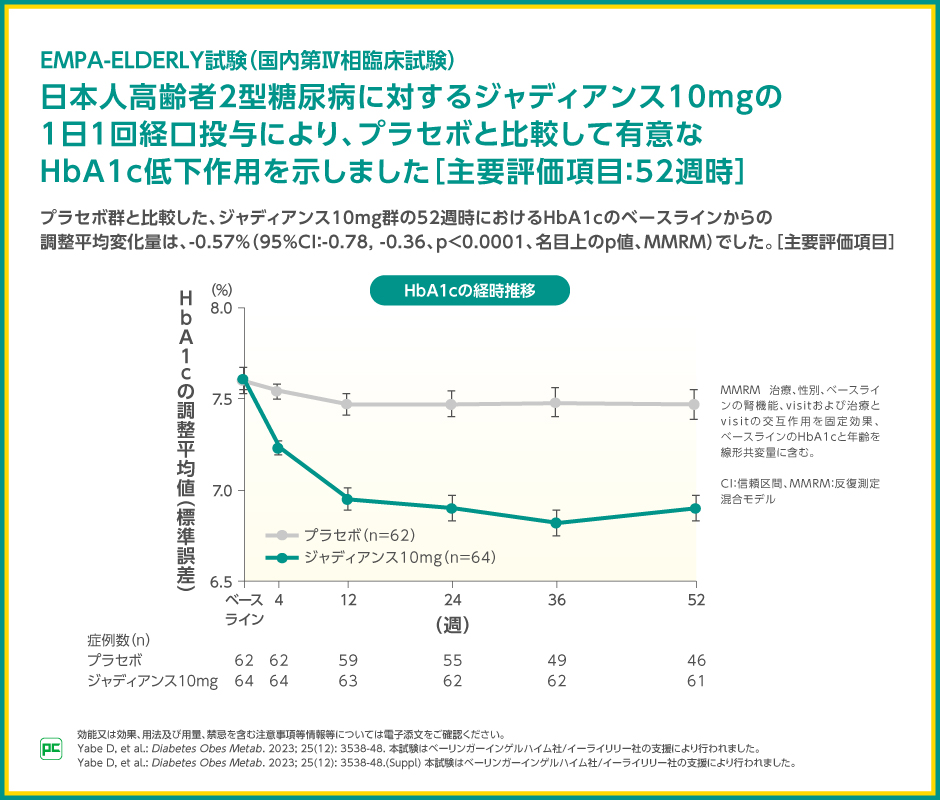
日本人高齢者2型糖尿病に対するジャディアンス10mgの1日1回経口投与による、プラセボ群と比較したジャディアンス10mg群の52週時のHbA1cのベースラインからの変化量は-0.57%であり、ジャディアンス10mg群で有意なHbA1c低下作用を示したことから(p<0.0001、名目上のp値、MMRM)、日本人高齢者2型糖尿病においてもジャディアンス10mg 1日1回投与による血糖改善効果が確認されました。
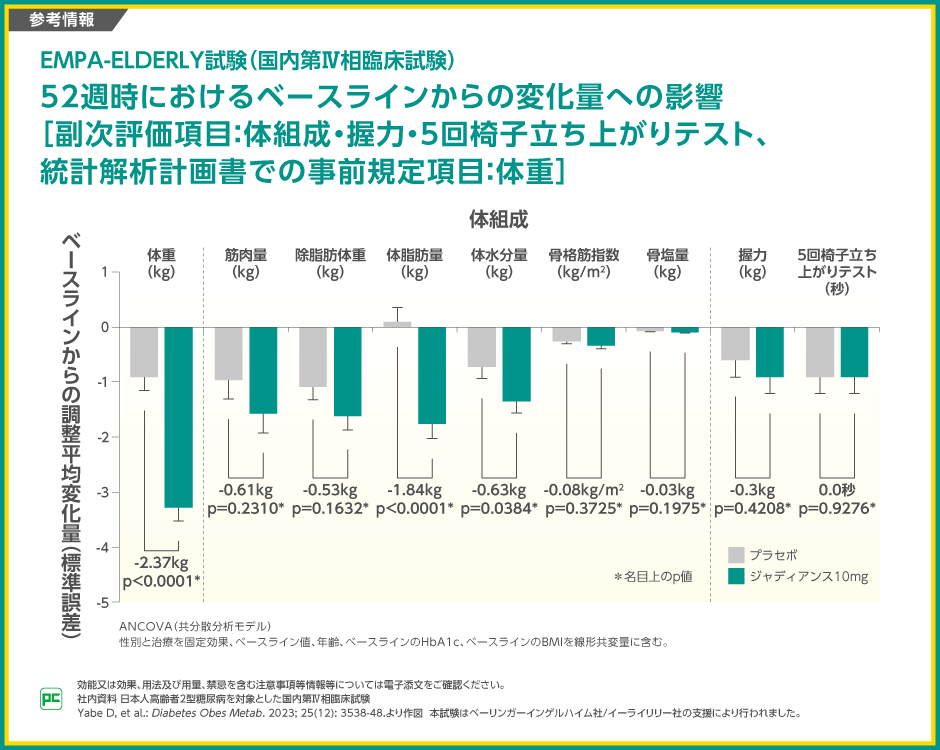
【参考情報】
52週時のベースラインからの変化量の、ジャディアンス10mg群とプラセボ群の差は、体重が-2.37kg(p<0.0001)、筋肉量が-0.61kg(p=0.2310)、除脂肪体重が-0.53(p=0.1632)、体脂肪量が-1.84kg(p<0.0001)、体水分量が-0.63kg(p=0.0384)、骨格筋指数が-0.08kg/m2(p=0.3725)、骨塩量が-0.03kg(p=0.1975)、握力が-0.3kg(p=0.4208)、5回椅子立ち上がりテストが0.0秒(p=0.9276、いずれも名目上のp値、ANCOVA)でした。
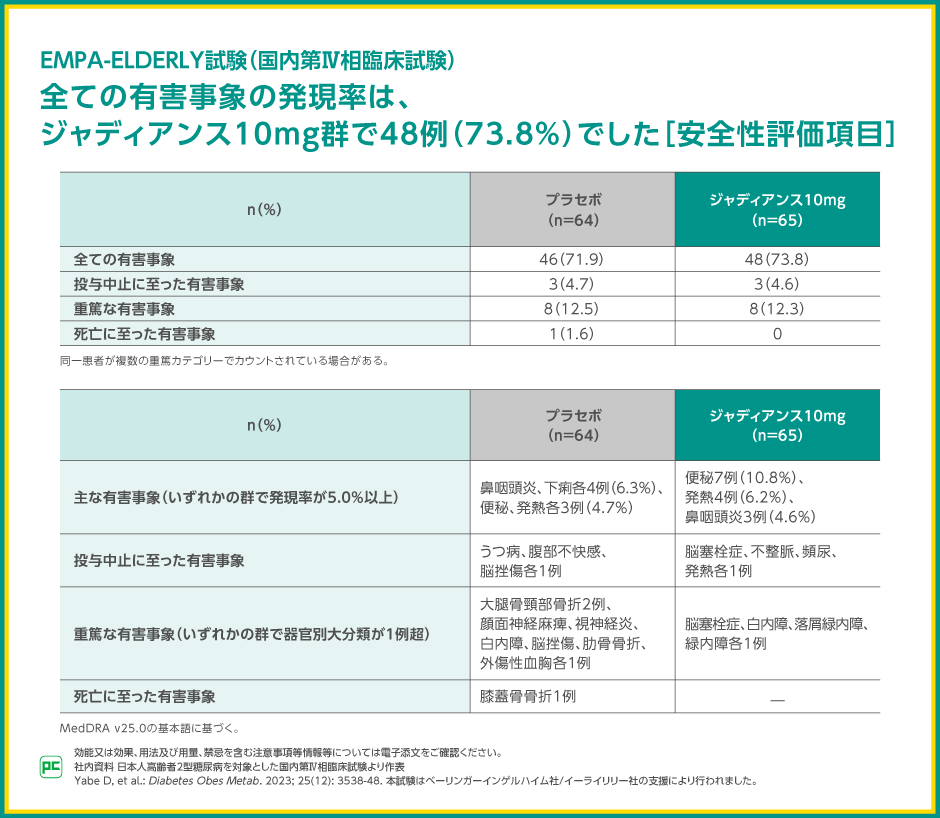
EMPA-ELDERLY試験における有害事象の発現率は、ジャディアンス10mg群で73.8%(48/65例)、プラセボ群で71.9%(46/64例)でした。
投与中止に至った有害事象は、それぞれ4.6%(3/65例)、4.7%(3/64例)、重篤な有害事象はそれぞれ12.3%(8/65例)、12.5%(8/64例)、死亡に至った有害事象はプラセボ群1.6%(1/64例)で、ジャディアンス10mg群では報告されませんでした。
主な有害事象は、ジャディアンス10mg群で便秘10.8%(7/65例)、発熱6.2%(4/65例)等、プラセボ群で鼻咽頭炎6.3%(4/64例)、下痢6.3%(4/64例)等でした。
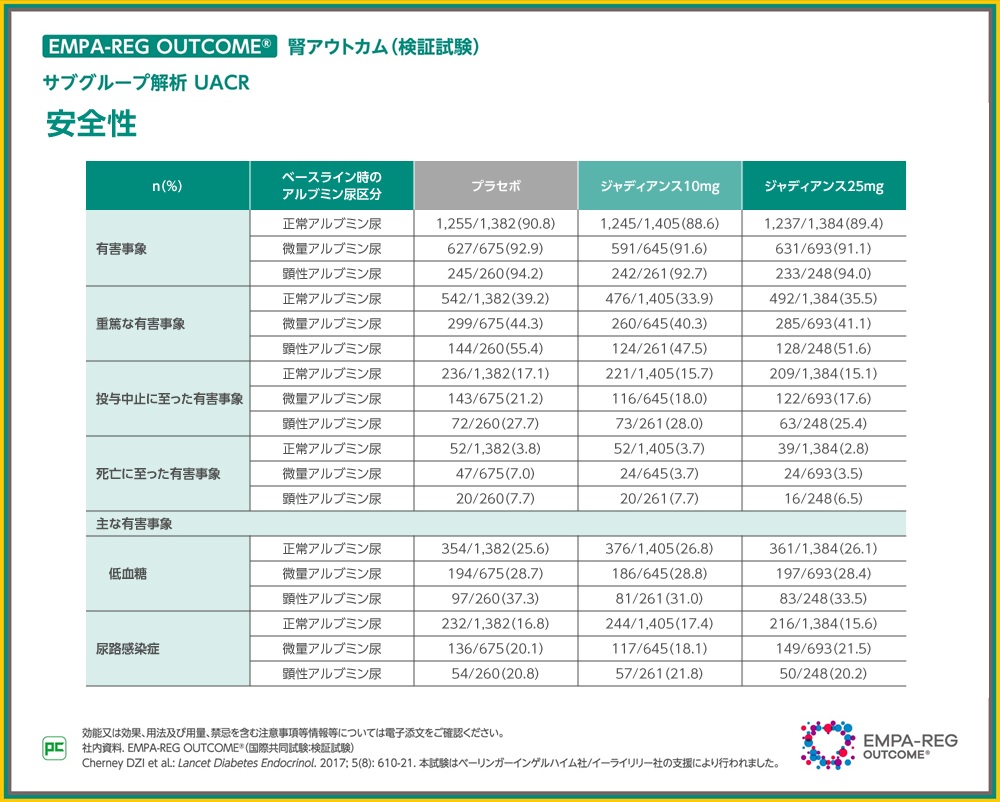
投与中止に至った有害事象、重篤な有害事象、死亡に至った有害事象の内訳は表のとおりです。
日本におけるジャディアンス特定使用成績調査

ジャディアンスでは、2型糖尿病の治療を目的として初めてジャディアンスを服用する方を対象に、特定使用成績調査が実施されました。
7,931例の2型糖尿病のある方を、ジャディアンス投与開始から3年間にわたって前向きに観察し、副作用の発現状況を調査しました。
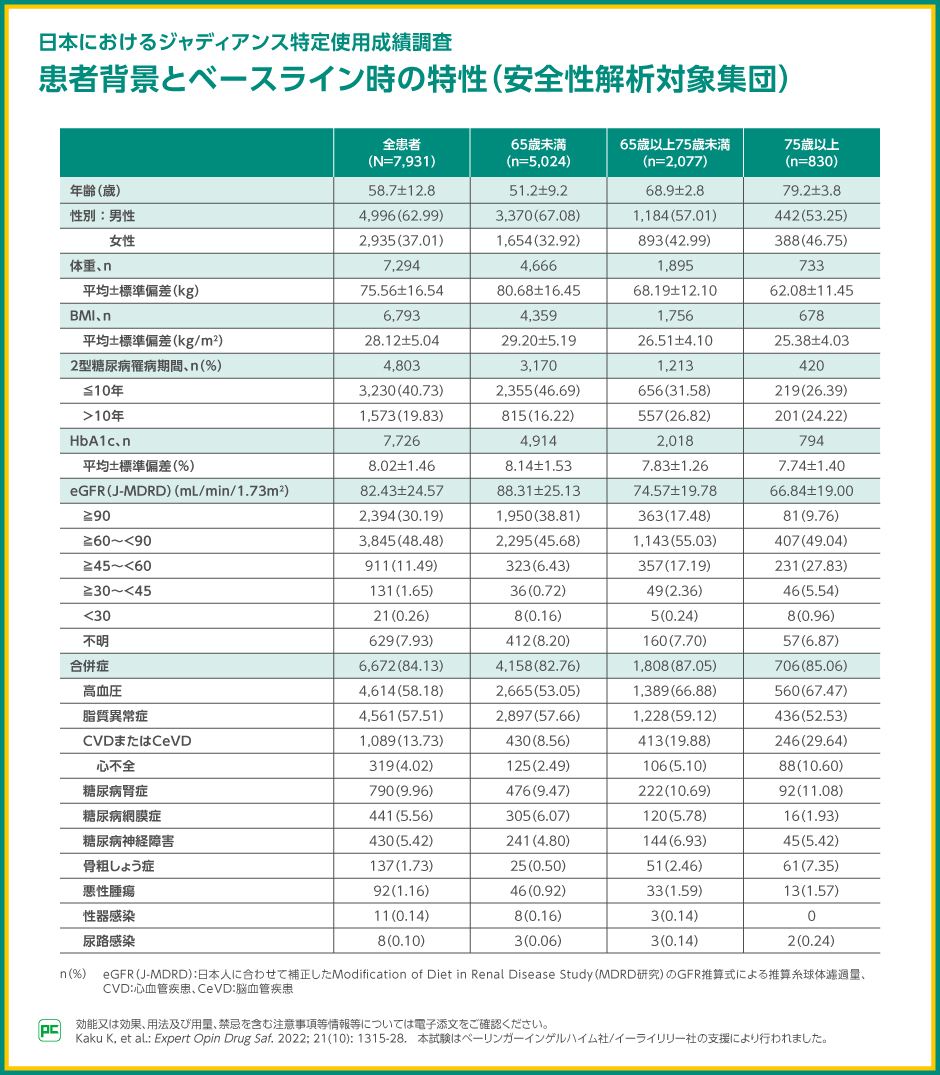
安全性解析対象集団の平均年齢は58.7歳で、75歳以上の割合は10.5%(830例)でした。全患者の平均HbA1cは8.02%、平均eGFRは82.43mL/分/1.73m2で、75歳以上では7.74%および66.84mL/分/1.73m2でした。合併症としては、高血圧、脂質異常症が多くみられました。
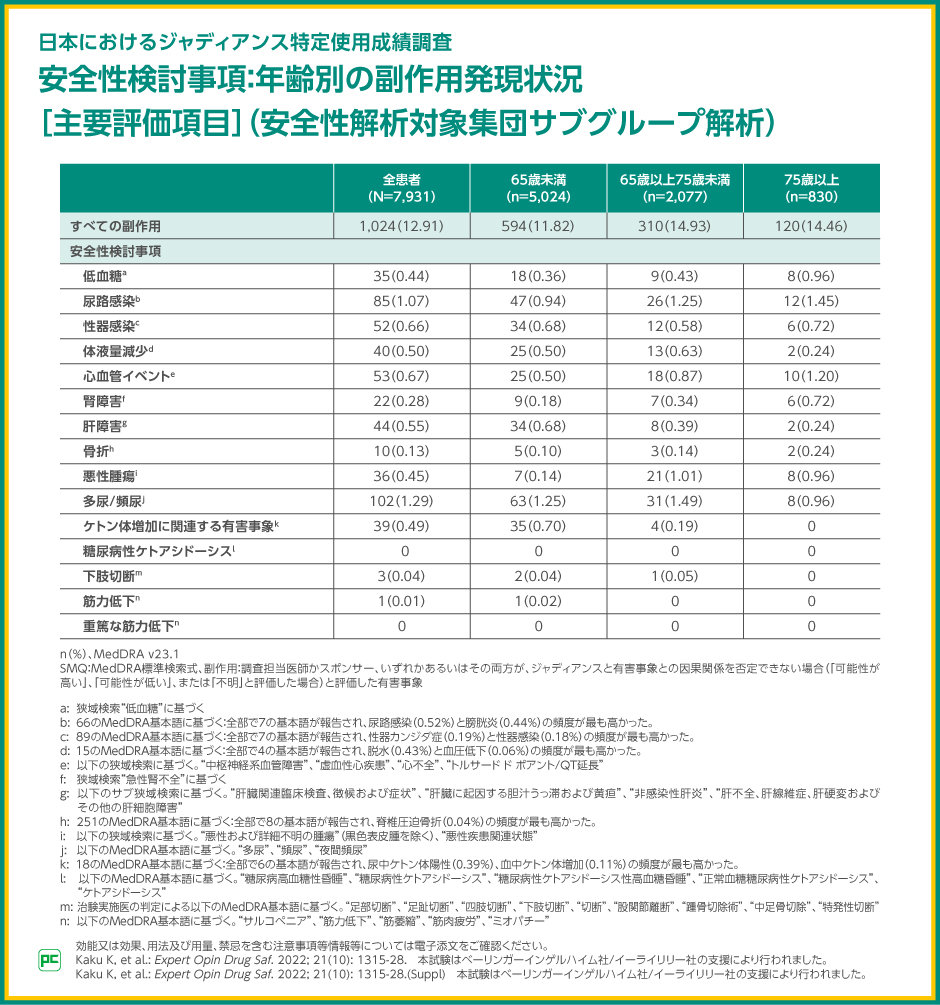
副作用は12.91%(1,024/7,931例)に発現しました。主な副作用は、多尿・頻尿1.29%(102/7,931例)、尿路感染1.07%(85/7,931例)、心血管イベント0.67%(53/7,931例)、性器感染0.66%(52/7,931例)などでした。

また本調査では、事前に規定されたサブグループ解析として、BMI別の解析も実施されました。
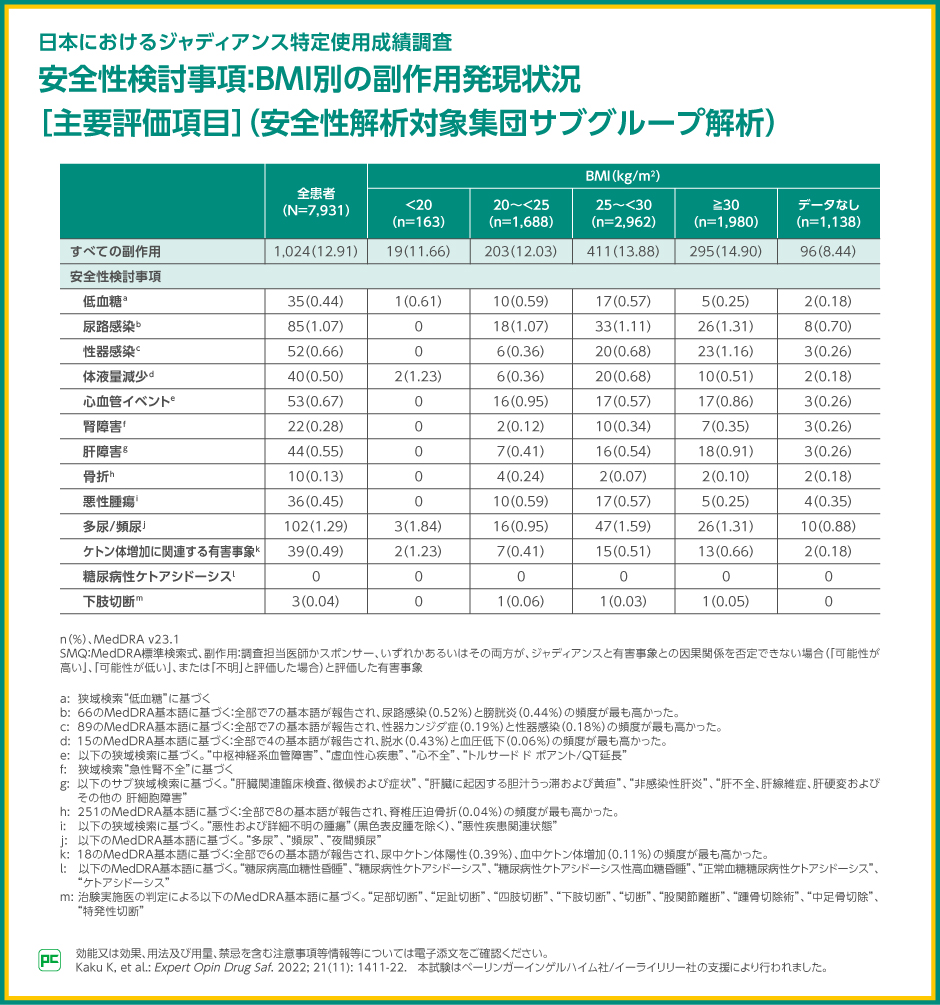
BMI別の副作用発現割合は、20kg/m2未満で11.66%(19/163例)、20から25 kg/m2未満で12.03%(203/1,688例)、25から30 kg/m2未満で13.88%(411/2,962例)、30 kg/m2以上で14.90%(295/1,980例)でした。
副作用のBMI別の発現割合は、図にお示しした通りです。
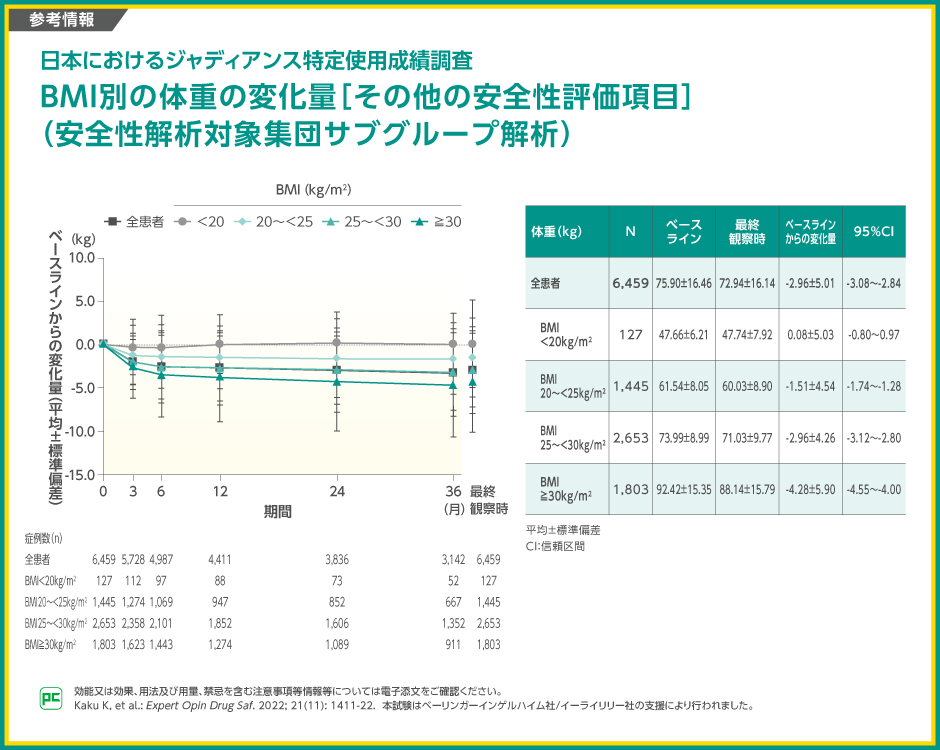
【参考情報】
ベースラインから最終観察時までの体重の変化量は全患者では-2.96kg(95%信頼区間:-3.08~-2.84)、BMI<20kg/m2では0.08kg(-0.80~0.97)、20~<25kg/m2では-1.51kg(-1.74~-1.28)、25~<30kg/m2では-2.96kg(-3.12~-2.80)、≧30 kg/m2では-4.28kg(-4.55~-4.00)でした。
2型糖尿病における腎イベントに対するジャディアンスの影響:EMPA-REG OUTCOME®腎アウトカム

さらにジャディアンスについては、EMPA-REG OUTCOME®試験により、心血管イベント発生のリスクが高い2型糖尿病のある方における腎アウトカムとして、アルブミン尿の変化に対する影響が検討されました。

なおこの試験には、eGFR≧60(正常または高値、軽度低下)で顕性アルブミン尿を呈さない患者、eGFR低下例で顕性アルブミン尿を呈さないDKD、eGFRに関わらず顕性アルブミン尿を呈するDKDといった幅広い腎機能の患者が含まれていました。
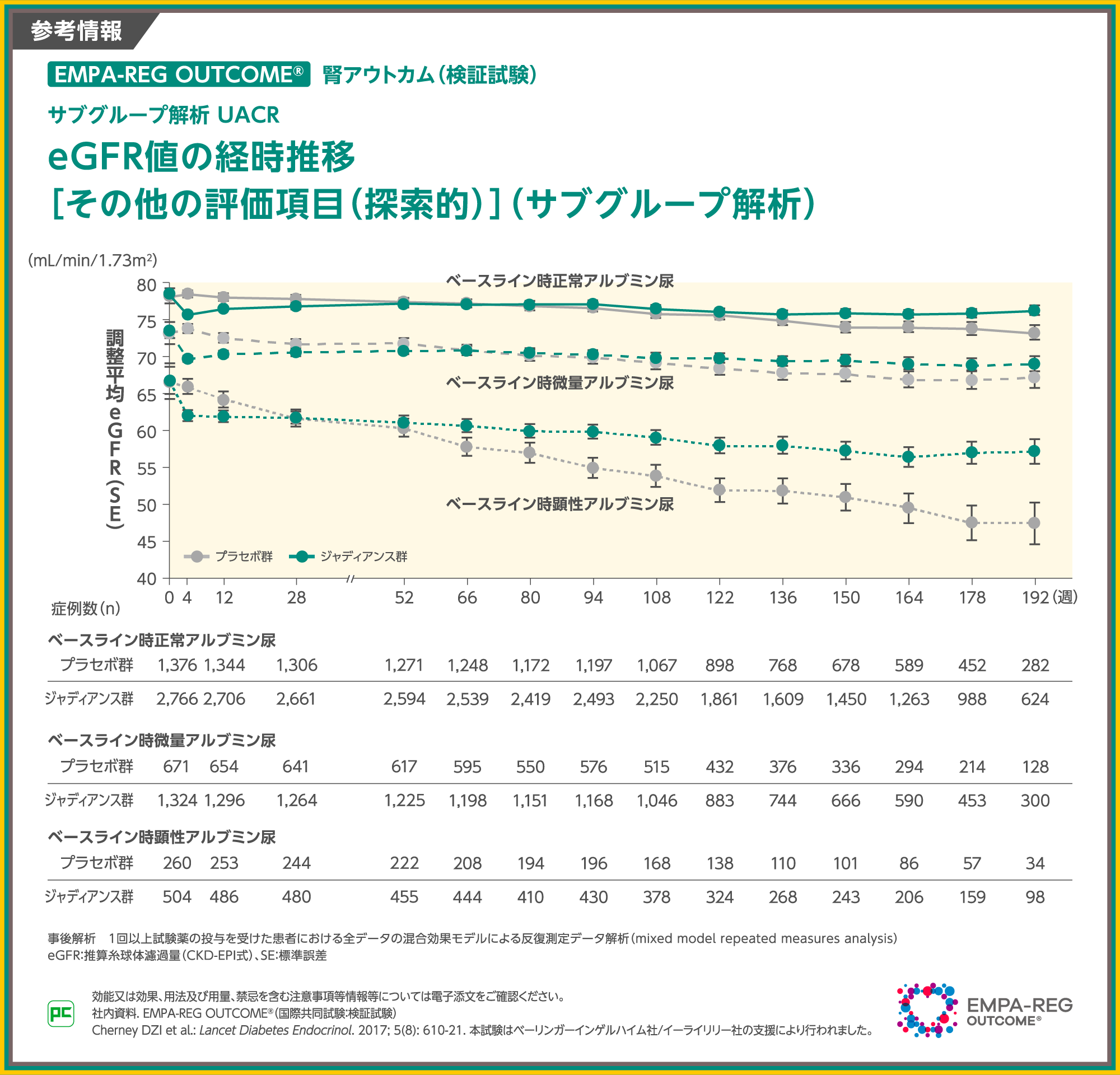
【参考情報】
ベースライン時のアルブミン尿カテゴリー別に192週までeGFRを追跡すると、図のように推移していました。
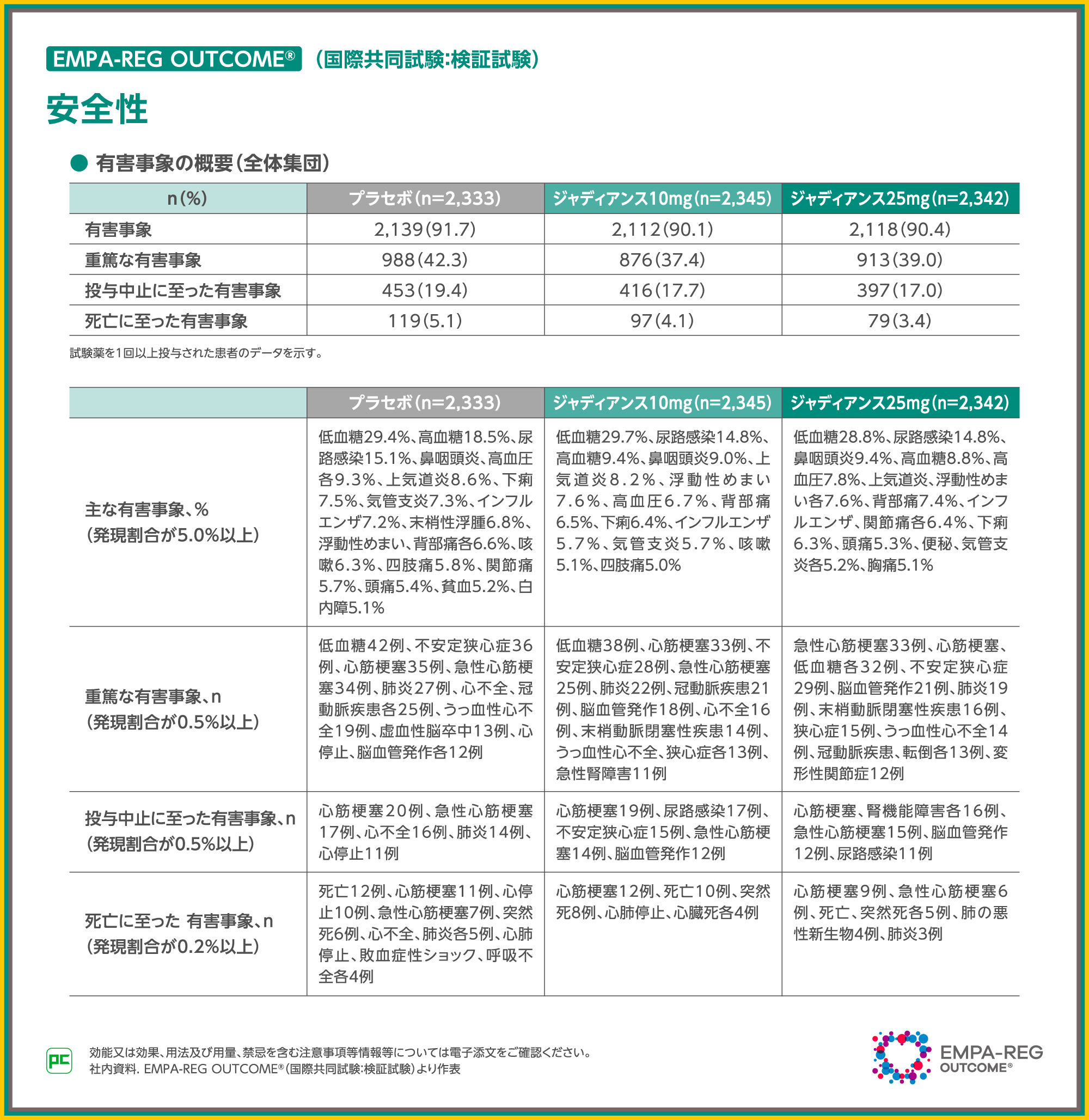
本試験での有害事象の発現率は、全体集団のジャディアンス10mg群で90.1%(2,112/2,345例)、25mg群で90.4%(2,118/2,342例)、プラセボ群で91.7%(2,139/2,333例)でした。本解析における有害事象は、ベースライン時に正常アルブミン尿の患者において、プラセボ群90.8%(1,255/1,382例)、ジャディアンス10mg群88.6%(1,245/1,405例)、ジャディアンス25mg群89.4%(1,237/1,384例)、ベースライン時に微量アルブミン尿の患者において、プラセボ群92.9%(627/675例)、ジャディアンス10mg群91.6%(591/645例)、ジャディアンス25mg群91.1%(631/693例)、ベースライン時に顕性アルブミン尿の患者において、プラセボ群94.2%(245/260例)、ジャディアンス10mg群92.7%(242/261例)、ジャディアンス25mg群94.0%(233/248例)に認められました。
その他の有害事象の発現状況については、スライドをご覧ください。
まとめ
ご紹介したように、ジャディアンスは高齢2型糖尿病における血糖低下作用、心血管ハイリスク2型糖尿病の腎機能に対するエビデンスを有する薬剤です。
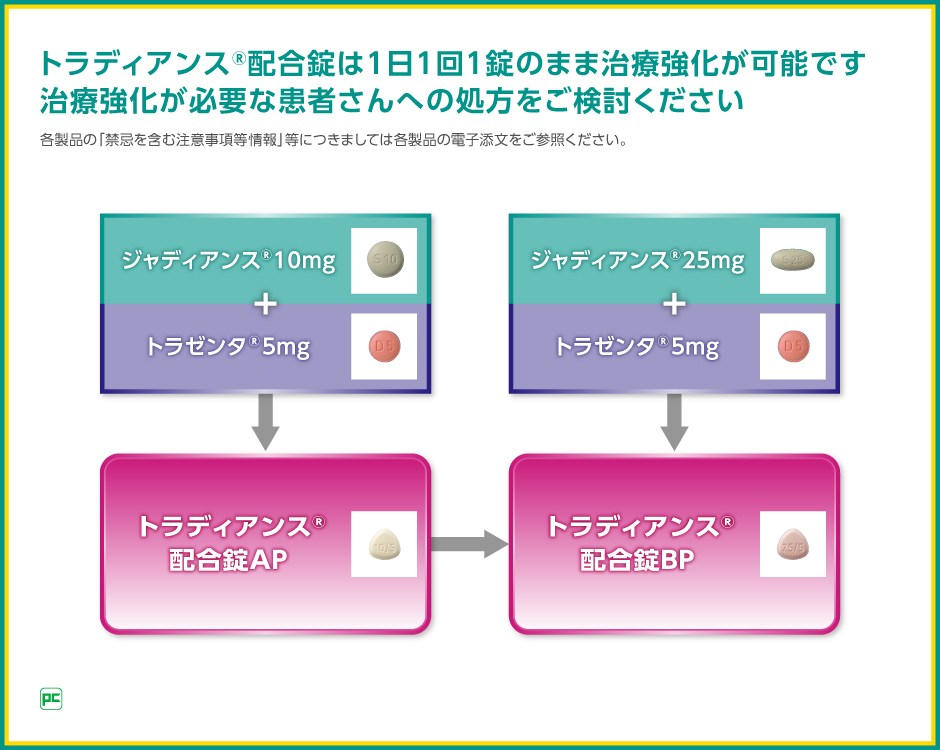
利便性の面では、ジャディアンスは10mg錠と25mg錠での用量調整が可能であり、またDPP-4阻害薬トラゼンタとの合剤であるトラディアンス配合錠をお使いいただけば、1日1回1錠のままで、治療強化が可能です。

糖尿病治療の目標は、糖尿病の合併症の発症・進展を阻止し、糖尿病のない方と変わらない寿命と日常生活の質(QOL)の実現を目指すことです1)。
高齢2型糖尿病の腎機能の低下リスクを考慮した治療に、ぜひジャディアンスの処方をご検討ください。
- 日本糖尿病学会編・著. 糖尿病治療ガイド2024, p21, 文光堂, 2024
その他の関連情報


糖尿病合併の慢性腎臓病に対する治療を再考する
日本ベーリンガーインゲルハイム
メディカルチャット 利用規約
当社の「日本ベーリンガーインゲルハイム メディカルチャット」(以下「本サービス」といいます)のご利用に際しては、本利用規約が適用されますので、必ず以下の記載事項をご確認下さい。
利用規約
- 本サービスは、当社所定のウェブページから文字によりお問い合わせいただくことにより、当社医薬品等に関する一般的な情報を、人工知能あるいは当社担当者により、文字及び図表により回答するサービスです(以下、人工知能による回答サービスを「AIチャット」、当社担当者による回答サービスを「有人チャット」といいます。)。ただし、AIチャットによる回答を原則とし、有人チャットは、AIチャットでの回答に対し、有人チャットでの回答も希望された場合に、提供させていただきます。
- 本サービスをご利用いただくことができるのは、当社医薬品等を扱いかつ国内に在住する医療関係者の方に限られます。当該医療関係者以外の方は、ご利用いただくことができません。
- 本利用規約に同意いただけない場合、本サービスを利用いただくことができません。本利用規約を最後までお読みいただき、「同意して利用する」ボタンを押した上で、本サービスをご利用下さい。
- 本サービスは、当社医薬品等に関する一般的なお問い合わせに対して回答するものとし、次の各号に掲げるお問い合わせについては、回答しないものとします。
- 当社医薬品等と関係のないお問い合わせ、または本サービスの回答範囲を逸脱したお問い合わせ
- 具体的な症状や治療方法に関するお問合せ
- 当社に適用される法令、ガイドラインまたは行政上の指導、当社自主規制その他当社が遵守すべきルールにより回答できないお問い合わせ
- 文字化け等により入力内容が判断できないお問い合わせ
- 前各号に掲げるほか、本サービスにより、適切な回答をすることができないと当社が判断した事項に関するお問い合わせ
- 本サービスは、日本語のみに対応しています。
- 本サービスは、当社医薬品の副作用、不具合及び有害事象の報告を受け付けていません。
- お問い合わせの内容によっては、本サービスでは十分に回答できない場合もございます。予めご了承下さい。
- 本サービスの利用可能時間は、以下のとおりです。
- AIチャット
24時間365日 - 有人チャット
平日9:00~17:00
- AIチャット
- 前項に関わらず、メンテナンス及び障害等のため一時的に本サービスを中断する場合がございます。
本サービスのご利用の際には、原則として、個人情報(お名前、ご住所、電話番号、メールアドレス等)を入力しないようお願いします。ただし、AIチャット及び有人チャットを問わず、当社医薬品の適用外使用に関するお問い合わせについては、コンプライアンス上の理由により、当社より、氏名及び施設名の入力を求める場合がございます。この場合には、当社プライバシーポリシーの内容を確認いただき、同意いただける場合に限り、入力して下さい(プライバシーポリシーについては「VIII 利用規約、プライバシーポリシー」に記載のURLからアクセス下さい)。その他の場合に、当社より個人情報の入力を求めることは一切ございません。
- 当社医薬品のご使用にあたっては、最新の添付文書等をご確認下さい。
- 当社は、本サービスまたは本サービスにより提供される情報の利用に際し生じた結果については、一切責任を負いません。
本サービスの利用にあたり、以下の各号の行為を禁止します。
- 本サービスにより提供される情報を複製、複写、転載、改変等する行為
- 第三者または当社の知的財産権その他の権利を侵害する行為
- 第三者または当社を誹謗中傷し、または名誉・信用を毀損する行為
- 本サービスの利用による営利目的の行為
- 本サービスの運営又は他の利用者による本サービスの利用の妨げとなる行為
- 前各号のほか、当社が不適当であると判断する行為
当社は、いつでも本サービスの提供を終了、またはその内容を変更することができるものとします。
本サービスの利用に関しては、以下の利用規約及びプライバシーポリシーが併せて適用されますので、ご確認下さい。



