ヘルネクシオス®錠60mg
本剤はがん化学療法後に増悪したHER2注)(ERBB2) 遺伝子変異陽性の切除不能な進行・再発の非小細胞肺癌に使用される、抗悪性腫瘍剤/HER2阻害剤です。
注) HER2:Human Epidermal Growth Factor Receptor Type 2(ヒト上皮増殖因子受容体2型、別称:c-erbB-2)
クイックリンク
重要なお知らせ
このページは医療関係者の方向けに使いやすさを配慮した処方に関連する資料です。公式の電子添文が必要な場合には、ページ下部のボタンよりPDF形式でダウンロードしてください。
警告
本剤は、緊急時に十分対応できる医療施設において、がん化学療法に十分な知識・経験を持つ医師のもとで、本剤の投与が適切と判断される症例についてのみ投与すること。また、治療開始に先立ち、患者又はその家族に有効性及び危険性を十分説明し、同意を得てから投与すること。
禁忌(次の患者には投与しないこと)
本剤の成分に対し過敏症の既往歴のある患者
製品の主な特徴
| 製品名 | ヘルネクシオス®錠60mg |
| 区分 | 劇薬、処方箋医薬品 |
| 適応症 | がん化学療法後に増悪したHER2(ERBB2)遺伝子変異陽性の切除不能な進行・再発の非小細胞肺癌 |
| 有効成分 | ゾンゲルチニブ |
製品の基本情報
組成
| 販売名 | ヘルネクシオス錠60mg |
| 有効成分 | 1錠中ゾンゲルチニブ60mg |
| 添加剤 | ヒプロメロース酢酸エステルコハク酸エステル、結晶セルロース、D-マンニトール、クロスカルメロースナトリウム、軽質無水ケイ酸、フマル酸ステアリルナトリウム、ポリビニルアルコール(部分けん化物)、タルク、酸化チタン、グリセリン脂肪酸エステル、ラウリル硫酸ナトリウム、黄色三二酸化鉄 |
製剤の性状
| 販売名 | ヘルネクシオス錠60mg |
| 色・剤形 | 黄色のフィルムコート錠 |
| 外形 | |
| 大きさ | 長径約15mm、短径約7mm |
| 厚さ | 約5mm |
| 重量 | 約414mg |
| 識別コード |
がん化学療法後に増悪したHER2(ERBB2)遺伝子変異陽性の切除不能な進行・再発の非小細胞肺癌
十分な経験を有する病理医又は検査施設における検査により、HER2(ERBB2)遺伝子変異が確認された患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
本剤の一次治療における有効性及び安全性は確立していない。
本剤の術前・術後補助療法における有効性及び安全性は確立していない。
「臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、本剤以外の治療の実施についても慎重に検討し、適応患者の選択を行うこと。[「臨床成績の項の国際共同第Ⅰa/Ⅰb相試験(Beamion LUNG-1試験)」の項参照]
通常、成人には、ゾンゲルチニブとして1日1回120mgを経口投与する。なお、患者の状態により適宜減量する。
他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
本剤投与により副作用が発現した場合には、以下の基準を参考に本剤を休薬、減量又は中止すること。1日1回60mgに減量しても忍容性が認められない場合は、本剤の投与を中止すること。
本剤の休薬、減量又は中止基準
副作用 | 重症度注) | 処置 |
| 肝機能障害 | Grade 3又は4のALT又はAST増加 | Grade 1以下又はベースラインに回復するまで休薬し、回復後は60mgで再開できる。 |
| Grade 3の総ビリルビン増加 | Grade 1以下又はベースラインに回復するまで休薬し、回復後は60mgで再開できる。 | |
| Grade 4の総ビリルビン増加 | 投与を中止する。 | |
| ALT又 はASTが基準値上限の3倍以上かつ総ビリルビンが基準値上限の2倍以上 | 投与を中止する。 | |
| 下痢 | Grade 2かつ止瀉薬の投与を行っても症状が2日以上継続する場合 | Grade 1以下に回復するまで休薬し、回復後は60mgで再開できる。 |
| Grade 3又は4 | Grade 1以下に回復するまで休薬する。 14日以内に回復した場合は60mgで再開できる。支持療法を行っても14日以内に回復しない場合は、投与を中止する。 | |
| 発熱性好中球減少症 | 全Grade | Grade 1以下又はベースラインに回復するまで休薬し、回復後は60mgで再開できる。ただし、必要に応じて投与を中止することも考慮する。 |
| 駆出率減少 | Grade 2 | Grade 1以下に回復するまで休薬し、回復後は120mgで再開できる。ただし、休薬後4週間以内に正常範囲又はベースラインから5ポイント以内に回復しなかった場合、再開後にベースラインから10ポイント以上低下した場合は60mgに減量する。 |
| Grade 3又は4 | Grade 1以下に回復するまで休薬し、回復後は60mgで再開できる。ただし、休薬後4週間以内に正常範囲又はベースラインから5ポイント以内に回復しなかった場合、再開後にベースラインから10ポイント以上低下した場合は投与を中止する。 | |
| 間質性肺疾患 | Grade 2 | Grade 1以下に回復するまで休薬する。14日以内に回復した場合は60mgで再開できる。支持療法を行っても14日以内にGrade 1以下に回復しない場合は投与を中止する。 |
| Grade 3又は4 | 投与を中止する。 | |
| その他の副作用 | Grade 3又は4 | Grade 1以下又はベースラインに回復するまで休薬し、回復後は60mgで再開できる。ただし、必要に応じて投与を中止することも考慮する。 |
注)GradeはNCI-CTCAE v5.0に準じる。
肝機能障害があらわれることがあるので、本剤投与開始前及び投与中は定期的に肝機能検査を行い、患者の状態を十分に観察すること。[「副作用の項の肝機能障害(35.2%)」の項参照]
血球減少があらわれることがあるので、本剤投与開始前及び投与中は定期的に血液検査を行い、患者の状態を十分に観察すること。[「副作用の項の血球減少」の項参照]
間質性肺疾患があらわれることがあるので、初期症状(呼吸困難、咳嗽、発熱等)の確認及び胸部画像検査の実施等、患者の状態を十分に観察すること。また、患者に対して、初期症状があらわれた場合には、速やかに医療機関を受診するよう説明すること。[「副作用の項の間質性肺疾患(1.3%)」の項参照]
左室駆出率(LVEF)低下があらわれることがあるので、本剤投与開始前及び本剤投与中は適宜心機能検査(心エコー等)を行い、患者の状態(LVEFの変動を含む)を十分に観察すること。[「特定の背景を有する患者に関する注意の項の左室駆出率(LVEF)が低下している患者」の項参照]
合併症・既往歴等のある患者
- 左室駆出率(LVEF)が低下している患者
LVEF低下を悪化させるおそれがある。[「重要な基本的注意」の項参照]
肝機能障害患者
- 中等度以上の肝機能障害を有する患者
本剤は主に肝臓で代謝されるため、血中濃度が上昇する可能性がある。なお、中等度以上の肝機能障害のある患者注)を対象とした臨床試験は実施していない。
注)NCI-ODWG(National Cancer Institute-Organ Dysfunction Working Group)基準による分類
生殖能を有する者
- 妊娠する可能性のある女性には、本剤投与中及び最終投与後10日間において避妊する必要性及び適切な避妊法について説明すること。[「特定の背景を有する患者に関する注意の項の妊婦」の項参照]
- 生殖可能な女性に投与する場合には、受胎能の低下があらわれる可能性があることを考慮すること。動物実験(ラット)において、子宮の萎縮、並びに子宮頸部及び膣の過形成/過角化が報告されている。
妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。生殖発生毒性試験(ラット)において、本剤の胎児への移行の可能性が推定され、本剤120mg投与時の4.4倍に相当する曝露量で胚・胎児死亡が報告されている。[「特定の背景を有する患者に関する注意の項の生殖能を有する者」、「特定の背景を有する患者に関する注意の項の授乳婦」の項参照]
授乳婦
授乳しないことが望ましい。本剤が乳汁に移行する可能性があり、乳児が乳汁を介して摂取した場合、乳児に重篤な副作用が発現するおそれがある。[「特定の背景を有する患者に関する注意の項の妊婦」の項参照]
小児等
小児等を対象とした本剤の有効性及び安全性は確立していない。
本剤は、主にCYP3Aによって代謝され、P-gp及びBCRPの阻害作用を示す。
併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
強いCYP3A誘導剤 カルバマゼピン、 リファンピシン、 フェニトイン等 [「薬物動態の項の臨床薬物相互作用試験」の項参照] | 本剤の有効性が減弱するおそれがあるため、これらの薬剤との併用は可能な限り避け、CYP3A誘導作用のない又は弱い薬剤への代替を考慮すること。 | これらの薬剤がCYP3Aを誘導することにより、本剤の血中濃度が低下する可能性がある。 |
治療域の狭いP-gpの基質となる薬剤 シクロスポリン、エベロリムス、シロリムス等 [「薬物動態の項の臨床薬物相互作用試験」の項参照] | これらの薬剤の副作用が増強されるおそれがあるため、患者の状態を慎重に観察し、副作用の発現に十分注意すること。 | 本剤がP-gpを阻害することにより、これらの薬剤の血中濃度が上昇する可能性がある。 |
BCRPの基質となる薬剤 ロスバスタチン、メトトレキサート、サラゾスルファピリジン等 [「薬物動態の項の臨床薬物相互作用試験」の項参照] | 本剤がBCRPを阻害することにより、これらの薬剤の血中濃度が上昇する可能性がある。 |
薬剤交付時の注意
- 湿気を避けるため、乾燥剤を同封したボトル包装品のまま患者に交付すること。
- 湿気を避けるため、乾燥剤を同封した元の容器にて保存し、使用の都度、密栓するよう患者に指導すること。
血中濃度
・反復投与
HER2(ERBB2)遺伝子異常を有する進行固形癌患者24例(日本人患者6例含む)に本剤60、120、又は240mgを空腹時に1日1回15日間反復経口投与注1)したときのゾンゲルチニブの血漿中濃度の時間推移及び薬物動態パラメータは以下の図1及び表1のとおりであった1)。
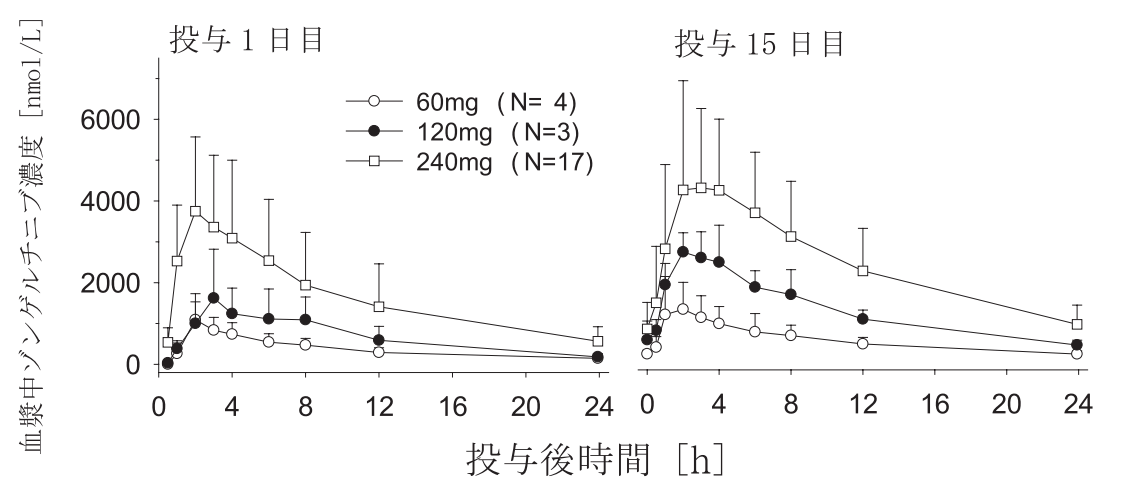
図1 本剤60、120又は240mgを1日1回反復経口投与注1)したときの血漿中濃度推移
(算術平均+標準偏差)
表1 本剤60、120又は240mgを1日1回反復経口投与注1)したときの薬物動態パラメータ
| 用量 | 投与日 | 例数 | Cmax (nmol/L) | tmax※1 (h) | AUC0-24h (nmol·h/L) | t1/2 (h) |
| 60mg | 1 | 4 | 1020 (44.2) | 1.99 (1.97-2.05) | 8240 (37.0) | 9.41 (17.4) |
| 15 | 4 | 1230 (54.3) | 2.04 (1.07-2.93) | 11600 (48.4) | 9.37 (15.2) | |
| 120mg | 1 | 3 | 1610 (75.1) | 3.03 (2.03-3.95) | 14000 (61.8) | 9.51 (9.87) |
| 15 | 3 | 2830 (20.6) | 2.05 (1.03-3.97) | 28900 (23.2) | 8.52 (9.39) | |
| 240mg | 1 | 17 | 3630 (45.1) | 2.07 (0.967-5.95) | 33900 (48.9)※2 | 9.19 (29.3)※2 |
| 15 | 17 | 4760 (41.4) | 2.95 (1.03-6.00) | 52100 (43.2) | 9.58 (30.1) |
幾何平均値(幾何変動係数%)
※1:tmaxは中央値(最小値-最大値)
※2:15例
吸収
・バイオアベイラビリティ
健康成人(7例)に本剤60mg注1)を単回経口投与したときの絶対バイオアベイラビリティは76%であった2)。(外国人データ)
・食事の影響
健康成人(16例)に本剤240mg注1)を単回経口投与したとき、空腹時投与に対する高脂肪食後投与におけるゾンゲルチニブのAUC0-t及びCmaxの幾何平均値の比は、それぞれ1.27及び1.26であった3)。(外国人データ)
分布
ゾンゲルチニブのヒト血漿タンパク結合率は99%超であり、主にアルブミンに結合した(in vitro)4)。ゾンゲルチニブの血液/血漿中濃度比は0.7であった(in vitro)5)。
代謝
ゾンゲルチニブは主にCYP3A4/5による酸化、UGT1A4によるグルクロン酸抱合及びグルタチオン抱合によって代謝される。健康成人(8例)に14C標識されたゾンゲルチニブ60mg注1)を単回経口投与したとき、血漿中に未変化体及び6種類の代謝物が検出され、血漿中総放射能量(AUC0-168h)の75%が未変化体であった6)。(外国人データ)
排泄
健康成人(8例)に14C標識されたゾンゲルチニブ60mg注1)を単回経口投与したとき、投与後11日までに投与量の94%が排泄され、糞便中には93%(未変化体として31%)、尿中には1.3%(未変化体として0.2%)が排泄された7)。(外国人データ)
特定の背景を有する患者
・腎機能障害患者
母集団薬物動態解析を用いて、腎機能注2)が正常(187例)、軽度(120例)及び中等度(23例)の腎機能障害患者にゾンゲルチニブ120mgを1日1回反復経口投与したときの曝露量を推定した結果、①Cmax及び②AUC0-24hの幾何平均値は、それぞれ①2730、2690及び2600nmol/L、並びに②30800、31700及び31200nmol·h/Lと推定された。
注2)eGFR(mL/min/1.73m2)が①90以上、②60以上90未満及び③30以上60未満の場合、それぞれ①正常、②軽度及び③中等度とされた8)。
・肝機能障害患者
母集団薬物動態解析を用いて、肝機能注3)が正常(288例)及び軽度(90例)の肝機能障害患者にゾンゲルチニブ120mgを1日1回反復経口投与したときの曝露量を推定した結果、①Cmax及び②AUC0-24hの幾何平均値は、それぞれ①2700及び2630nmol/L、並びに②31000及び30500nmol·h/Lと推定された8)。
注3)NCI-ODWG(National Cancer Institute - Organ Dysfunction Working Group)基準による分類
薬物相互作用
・臨床薬物相互作用試験
健康成人を対象とした臨床薬物相互作用試験から得られた、ゾンゲルチニブの薬物動態に及ぼす併用薬の影響及び併用薬の薬物動態に及ぼすゾンゲルチニブの影響は、以下の表2及び表3のとおりであった9)~13)。[「相互作用の項の併用注意(併用に注意すること)」の項参照]
表2 ゾンゲルチニブの薬物動態に及ぼす併用薬の影響
| 併用薬 | 用法・用量 | 例数※1 | ゾンゲルチニブの単独 投与時に対する比※2 | ||
| 併用薬 | ゾンゲル チニブ注1) | Cmax | AUC0-∞ | ||
| イトラコナゾール (強いCYP3A阻害剤) | 200mg QD | 15mg単回 | 16/16 | 1.27 (1.07, 1.51) | 1.41 (1.26, 1.58) |
| カルバマゼピン (強いCYP3A誘導剤) | 600mg QD※3 | 60mg単回 | 15/16 | 0.56 (0.45, 0.71) | 0.36 (0.32, 0.42) |
| ラベプラゾール (プロトンポンプ阻害剤) | 40mg QD | 30mg単回 | 11/12 | 0.87 (0.67, 1.13) | 0.97 (0.85, 1.10) |
QD:1日1回
※1:併用/非併用時
※2:幾何平均値の比(90%信頼区間)
※3:カルバマゼピンは200mgを4日間QD、400mgを7日間QD、600mgを13日間QDの順に投与
表3 併用薬の薬物動態に及ぼすゾンゲルチニブの影響
| 併用薬 | 用法・用量 | 例数※1 | 併用薬の単独投与時に 対する比※2 | ||
| 併用薬 | ゾンゲル チニブ | Cmax | AUC0-∞ | ||
| ミダゾラム (CYP3A基質) | 1mg単回 | 120mg QD | 14/16 | 1.17 (1.08, 1.27) | 1.06 (0.95, 1.17) |
| レパグリニド (CYP2C8基質) | 0.5mg単回 | 14/16 | 1.44 (1.24, 1.69) | 1.30 (1.10, 1.53) | |
| オメプラゾール (CYP2C19基質) | 20mg単回 | 13/15※3 | 0.62 (0.45, 0.86) | 0.90 (0.62, 1.30) | |
| ダビガトラン (P-gp基質) | 150mg単回 | 120mg 単回 | 15/16 | 1.24 (0.96, 1.60) | 1.34 (1.06, 1.70) |
| ロスバスタチン (OATP1B1、 OATP1B3、 BCRP基質)※4 | 10mg単回 | 120mg QD | 16/16 | 3.02 (2.47, 3.68) | 2.30 (1.96, 2.71) |
| メトホルミン (MATE1、 MATE2-K基質) | 10mg単回 | 16/16 | 0.76 (0.68, 0.84) | 0.83 (0.76, 0.90) | |
| フロセミド (OAT1、OAT3 基質)※5 | 1mg単回 | 16/16 | 1.50 (1.16, 1.93) | 1.38 (1.20, 1.58) | |
QD:1日1回
※1:併用/非併用時
※2:幾何平均値の比(90%信頼区間)
※3:AUC0-∞では9/10
※4:ゾンゲルチニブ非併用投与時に対する併用投与時のコプロポルフィリンI(OATP1B1及びOATP1B3の内因性バイオマーカー)のCmax及びAUC0-72hの幾何平均値の比(90%信頼区間)は、それぞれ0.94(0.89, 0.98)及び0.86(0.82, 0.91)であった。
※5:フロセミドはBCRP基質でもあることが報告されている。
注1)承認された用法及び用量は、ゾンゲルチニブとして1日1回120mgである。
・その他
ゾンゲルチニブはUGT2B17を阻害する可能性が示唆された14)。また、ゾンゲルチニブはP-gp及びBCRPの基質である(in vitro)15)。
有効性及び安全性に関する試験
・国際共同第Ⅰa/Ⅰb相試験(Beamion LUNG-1試験)16)
HER2(ERBB2)遺伝子異常を有する切除不能な進行固形癌患者を対象とした国際共同第Ia/Ib相試験の第Ib相パートにおいて、HER2(ERBB2)遺伝子変異を有する切除不能な進行・再発の非小細胞肺癌患者322例に本剤120又は240mg注)を1日1回経口投与した。
白金系抗悪性腫瘍剤を含む1つ以上の化学療法歴のあるHER2(ERBB2)遺伝子(チロシンキナーゼドメイン)に変異を有する患者を対象としたコホートにおいて、主要評価項目であるRECIST ver.1.1に基づく盲検下独立中央審査判定による奏効率[97.5%信頼区間]は、本剤120mg投与群(75例、日本人9例を含む)で66.7%[53.8, 77.5](50/75例)であった(2024年5月23日データカットオフ)。
白金系抗悪性腫瘍剤を含む1つ以上の化学療法歴のあるHER2(ERBB2)遺伝子(チロシンキナーゼドメイン以外)に変異を有する患者を対象としたコホートにおいて、RECIST ver.1.1に基づく治験担当医師判定による奏効率は、本剤120mg投与群(12例)で41.7%(5/12例)であった(2024年8月29日データカットオフ)。
白金系抗悪性腫瘍剤を含む1つ以上の化学療法歴及びHER2を標的とした抗体薬物複合体による治療歴のあるHER2(ERBB2)遺伝子(チロシンキナーゼドメイン)に変異を有する患者を対象としたコホートにおいて、RECIST ver.1.1に基づく盲検下独立中央審査判定による奏効率[95%信頼区間]は、本剤120mg投与群(31例、日本人1例を含む)で41.9%[26.4, 59.2](13/31例)であった(2024年8月29日データカットオフ)。
第Ib相パートで本剤120mgが投与された236例(日本人23例を含む)のうち、副作用は210例(89.0%)に認められた。主な副作用は、下痢134例(56.8%)、発疹63例(26.7%)、ALT増加43例(18.2%)、AST増加43例(18.2%)、そう痒症36例(15.3%)であった。
注)承認された用法及び用量は、ゾンゲルチニブとして1日1回120mgである。
一般的名称:ゾンゲルチニブ(Zongertinib)(JAN)
化学名:N-[1-(8-{3-Methyl-4-[(1-methyl-1H-1,3-benzimidazol-5-yl)oxy]anilino}pyrimido[5,4-d]pyrimidin-2-yl)piperidin-4-yl]prop-2-enamide
分子式:C29H29N9O2
分子量:535.60g/mol
性状:黄色~暗黄色又は橙色の粉末である。
化学構造式:
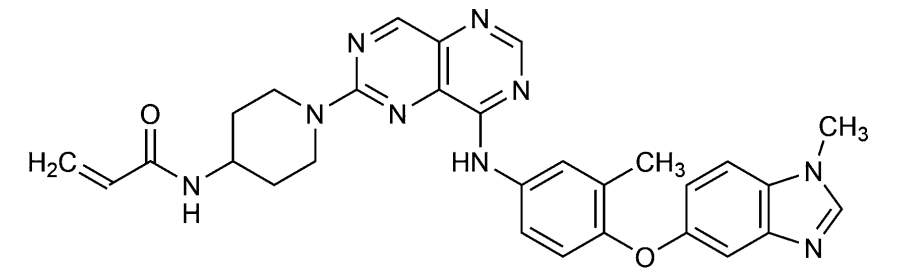
分配係数:log P=log D(pH7.4)=4.7
医薬品リスク管理計画を策定の上、適切に実施すること。
14錠(ボトル、乾燥剤入り)
- 社内資料:国際共同第I相試験(Beamion LUNG-1)(2025年9月19日承認、CTD 2.7.2.3)
- 社内資料:ヒトADME試験(2025年9月19日承認、CTD 2.7.2.2)
- 社内資料:食事の影響試験(2025年9月19日承認、CTD 2.7.1.2)
- 社内資料:非臨床薬物動態試験(in vitro血漿タンパク結合)(2025年9月19日承認、CTD 2.6.4.4)
- 社内資料:非臨床薬物動態試験(in vitro血球移行性)(2025年9月19日承認、CTD 2.6.4.4)
- 社内資料:ヒトADME試験における代謝物同定(2025年9月19日承認、CTD 2.6.4.5)
- 社内資料:ヒトADME試験(2025年9月19日承認、CTD 2.7.2.2、CTD 2.7.2.3)
- 社内資料:母集団薬物動態解析(2025年9月19日承認、CTD 2.7.2.3)
- 社内資料:イトラコナゾールとの薬物相互作用試験(2025年9月19日承認、CTD 2.7.2.2)
- 社内資料:カルバマゼピンとの薬物相互作用試験(2025年9月19日承認、CTD 2.7.2.2)
- 社内資料:ラベプラゾールとの薬物相互作用試験(2025年9月19日承認、CTD 2.7.1.2)
- 社内資料:CYP基質とのカクテル薬物相互作用(2025年9月19日承認、CTD 2.7.2.2)
- 社内資料:トランスポーター基質とのカクテル薬物相互作用(2025年9月19日承認、CTD 2.7.2.2)
- 社内資料:非臨床薬物動態試験(in vitro薬物代謝酵素誘導及び阻害)(2025年9月19日承認、CTD 2.6.4.5)
- 社内資料:非臨床薬物動態試験(薬物トランスポーターによる輸送)(2025年9月19日承認、CTD 2.6.4.7)
- 社内資料:国際共同第I相試験(Beamion LUNG-1)
- 社内資料:非臨床薬効薬理試験(in vitro、がん細胞株における増殖阻害作用)(2025年9月19日承認、CTD 2.6.2.2)
- 社内資料:非臨床薬効薬理試験(in vivo、PDXモデルマウスにおける腫瘍増殖抑制作用)(2025年9月19日承認、CTD 2.6.2.2)


