
ヘルネクシオス®の作用機序と臨床効果
サイトへ公開:2025年10月17日 (金)
クイックリンク

進行/転移性のHER2(ERBB2)遺伝子変異陽性の非小細胞肺癌(NSCLC)患者に対し、新規のHER2チロシンキナーゼ阻害剤であるヘルネクシオス®の有効性と安全性を評価した非盲検国際多施設共同試験、Beamion LUNG-1試験 第Ib相 用量拡大パート1,2)が報告されました。今回は、NSCLC研究において第一線でご活躍されている近畿大学医学部 内科学腫瘍内科部門 主任教授 林 秀敏先生にヘルネクシオス®の作用機序の観点から臨床効果についてお伺いしました。
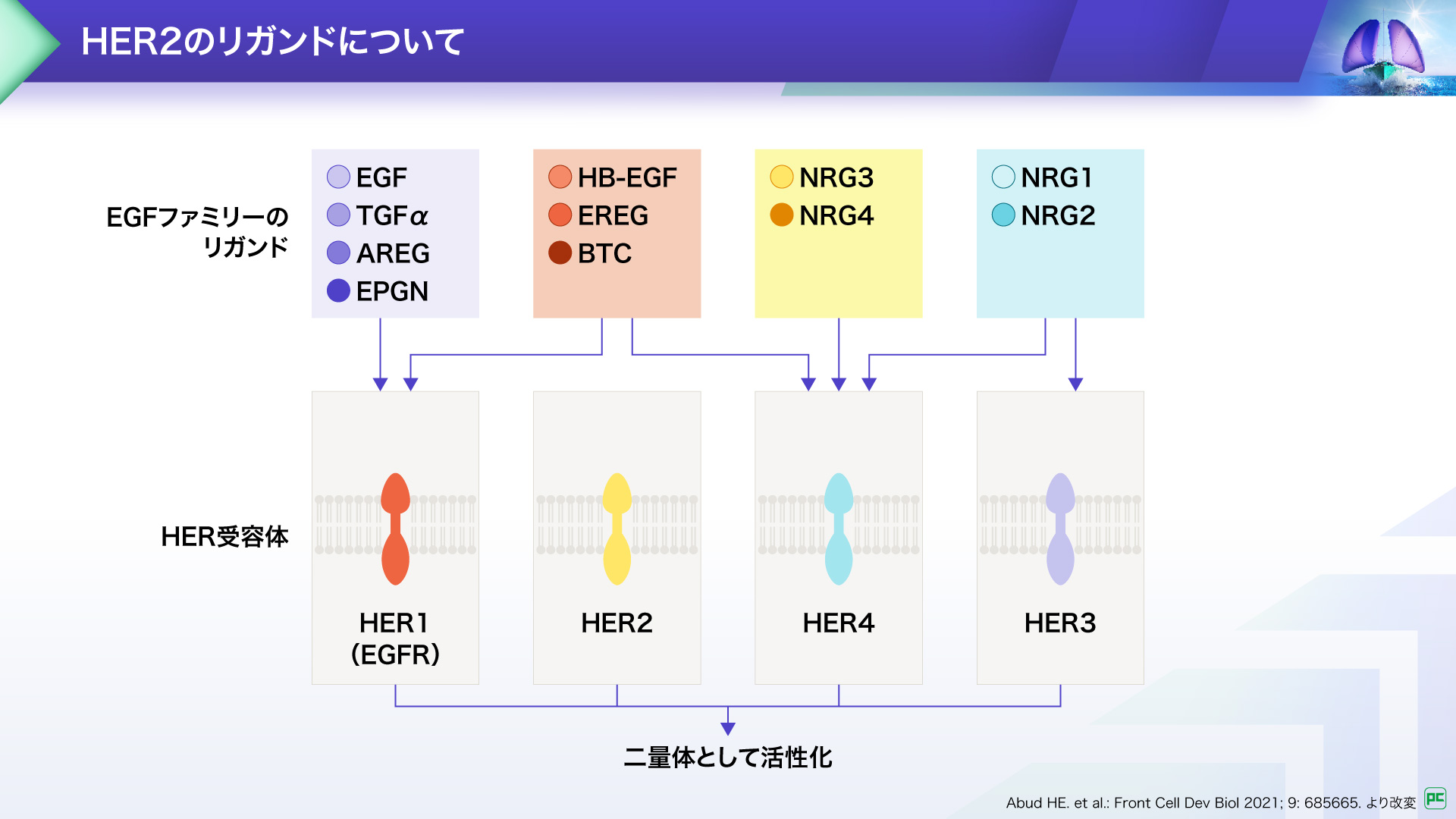
HER2のリガンドについて3)
HERファミリーには、HER1(EGFR)、HER2、HER3、HER4の4つの受容体があります。これらは、それぞれ特定のリガンド(結合分⼦)と結合し、⼆量体を形成することで活性化され、細胞の増殖や分化などに関与します。
ただし、HER2は他の受容体とは異なり、⾃⾝に結合するリガンドを持たず、ホモ二量体として活性化した状態で存在するか、他のHER受容体とヘテロ⼆量体を形成することで活性化されます。
さらに、HER2遺伝⼦に変異が⽣じると、がんの増殖を促すシグナル経路に異常が⽣じることが知られています
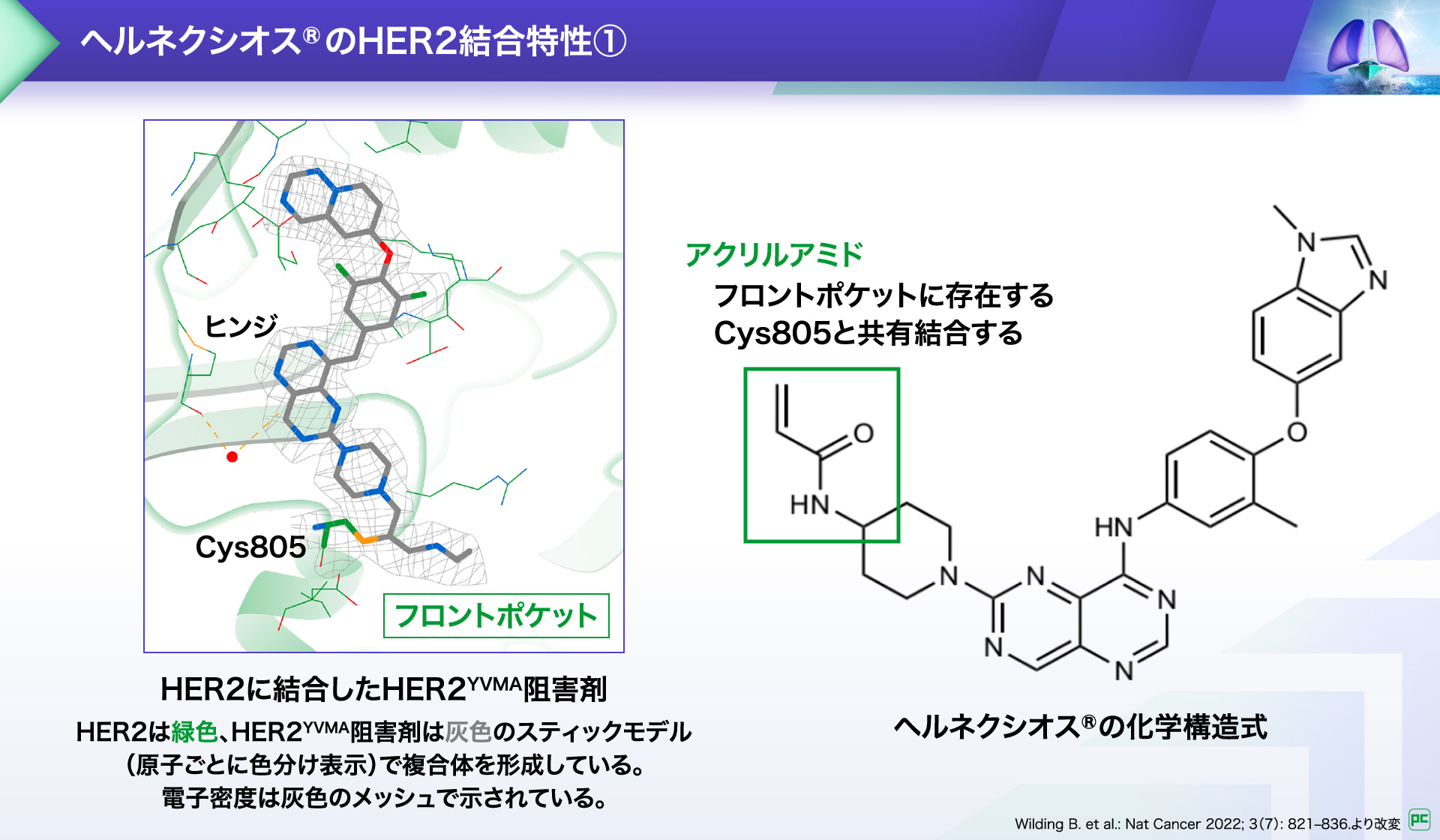
ヘルネクシオス®のHER2結合特性4)
他のHERファミリーへの影響を与えずに、HER2遺伝子変異によるがんの増殖シグナルを抑制するためには、ファミリーメンバー間の高い構造類似性の中で、HER2の活性化を選択的に阻害する必要があります。
HER2には複数の薬剤結合領域(ポケット)が存在し、薬剤がこれらの領域に正確に結合しなければ、ATPの結合によるキナーゼの活性化を阻害する⼗分な効果を発揮できません。しかし、HER2YVMA変異ではATP結合ポケット周辺の構造が変化するため薬剤の結合が困難でした。
ヘルネクシオス®の化学構造に含まれるアクリルアミドは、HER2のキナーゼドメイン内にあるフロントポケットに存在するCys805と共有結合することで、不可逆的に結合します。これによりATPの結合が阻害され、下流のシグナル伝達が抑制されます。
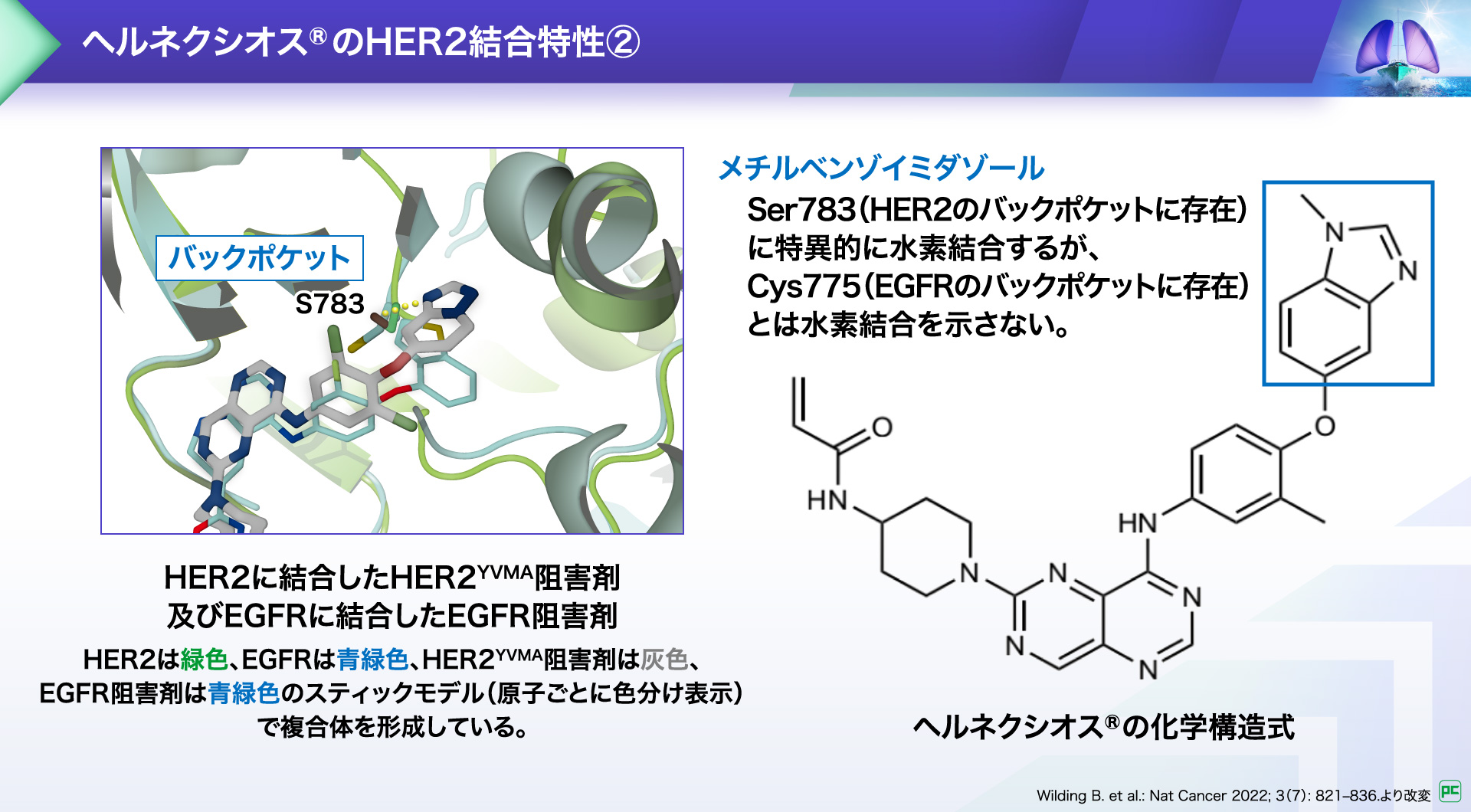
また、HER2のバックポケットにはSer783、EGFRにはCys775という結合部位が存在しますが、ヘルネクシオス®の化学構造に含まれるメチルベンゾイミダゾールは、Ser783に特異的に⽔素結合し、Cys775とは結合しないという特性を有しています。
これらの特性により、HER2に対して⾼い結合親和性を⽰します。
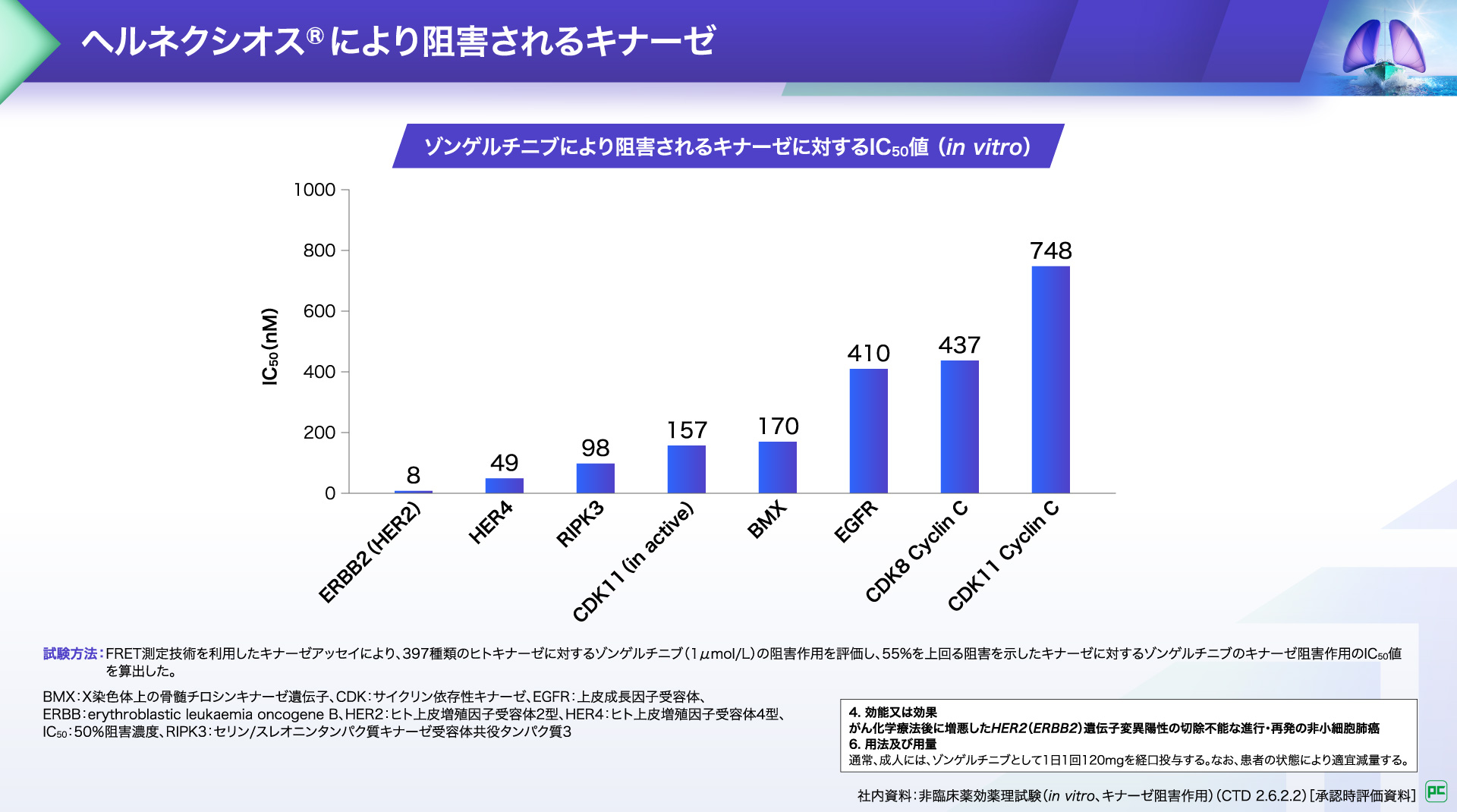
ヘルネクシオス®により阻害されるキナーゼ5)
ヘルネクシオス®は、グラフに⽰したEGFRを含む複数のキナーゼの中で、HER2に対して最も低いIC₅₀値を⽰し、他のキナーゼと⽐較し、低濃度処理においてもがん細胞の増殖抑制作⽤が認められました。
また、ヘルネクシオス®はEGFR阻害活性に必要な濃度の0.0195倍の濃度でHER2阻害活性を⽰しました。
ヘルネクシオス®の作用機序
ヘルネクシオス®は、経⼝投与可能な新規のHER2チロシンキナーゼ阻害剤です2)。
エクソン20挿⼊変異等を有するHER2のチロシンキナーゼ活性を阻害し、下流のシグナル伝達を阻害することにより、腫瘍増殖抑制作⽤を⽰すと考えられています6)。
また、ヘルネクシオス®の野⽣型EGFRに対するキナーゼ阻害活性は、HER2に対するキナーゼ阻害活性の0.0195倍でした5)。
これらの特性により、ヘルネクシオス®はHER2を阻害し、臨床においてもHER2遺伝⼦変異陽性NSCLCの腫瘍増殖及び疾患進⾏を抑制することが可能となります。

ここからは、ヘルネクシオス®の有効性と安全性を評価した「国際共同第I相試験Beamion LUNG-1試験」をご紹介します。
国際共同第Ⅰ相試験Beamion LUNG-1試験 試験概要
Beamion LUNG-1試験の第Ib相では、進⾏/転移性のHER2変異陽性NSCLC患者を対象に、ヘルネクシオス®の有効性と安全性を評価しました。
同試験では、⽇本を含む18ヵ国で241例が登録され、そのうち⽇本⼈患者は26例でした。
コホート1では、まず初めに⽤量最適化相として、治療歴のあるHER2変異陽性NSCLC患者を、ヘルネクシオス®120mg群または240mg群にランダムに割り付け、治療を実施しました。
その後、⽤量最適化相のデータを踏まえて、120mgを推奨⽤量とし、コホート1を含むすべてのコホートで240mg群への組⼊れは中⽌となりました。

試験結果
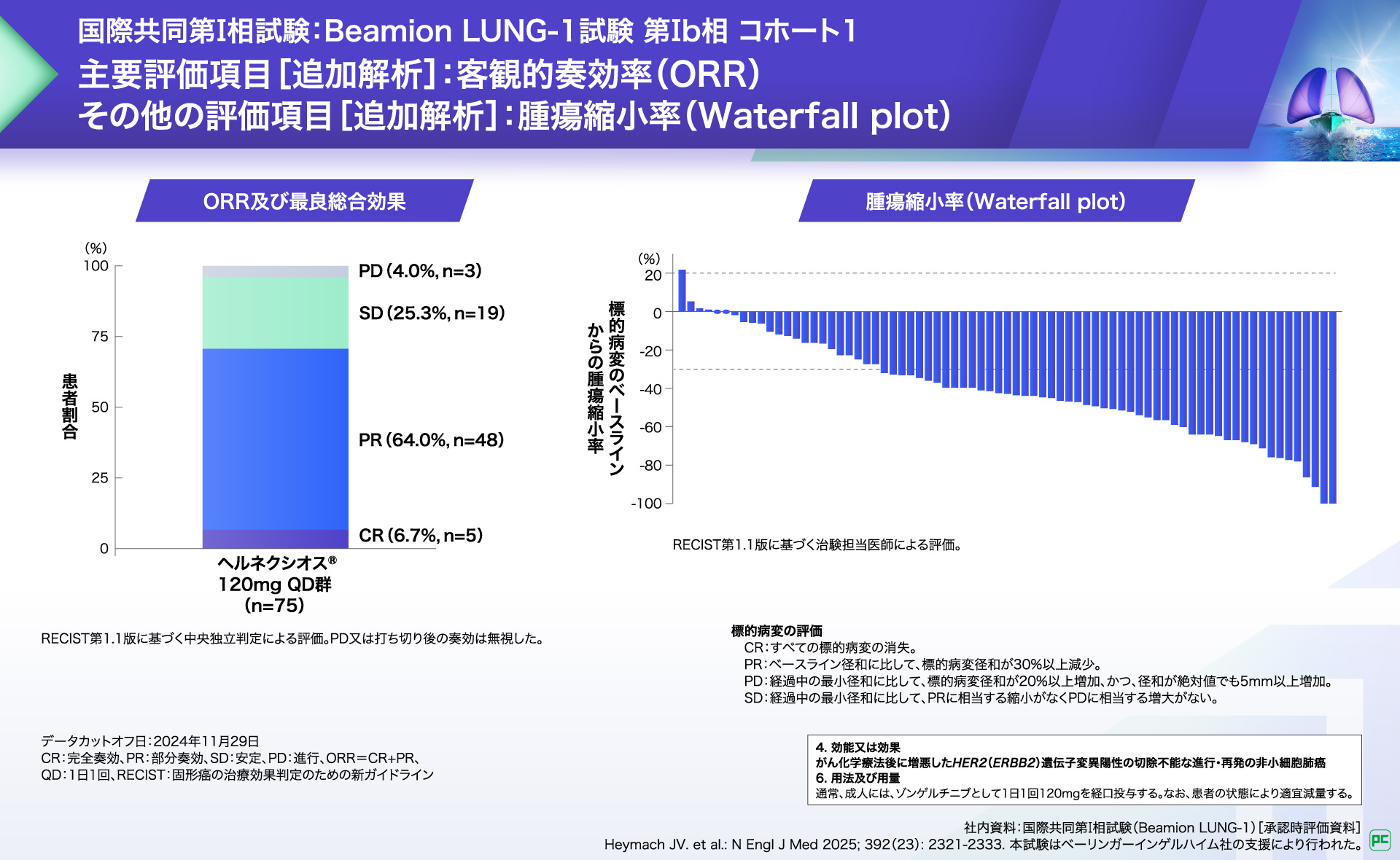
主解析において、客観的奏効率(ORR※1)は66.7%(50/75例、97.5%CI:53.8-77.5)と事前に規定された基準(ORR 30%)を上回りました(片側p<0.0001、検証的な解析結果、1標本z検定)。
また、副次評価項目である病勢コントロール率(DCR※2)は92.0%でした。
※1:ORR=CR+PR、※2:DCR=CR+PR+SD

FDAの指示に基づき、コホート1の全患者の6ヵ月以上の奏効期間フォローアップデータ及び3ヵ月安全性データを更新するため、追加解析が実施されました。
追加解析の結果、主要評価項⽬である客観的奏効率(ORR)は70.7%(53/75例、95%CI:59.6-79.8)でした。
また、ベースラインからの腫瘍縮⼩率の中央値は-43%(範囲:-100-22)でした。
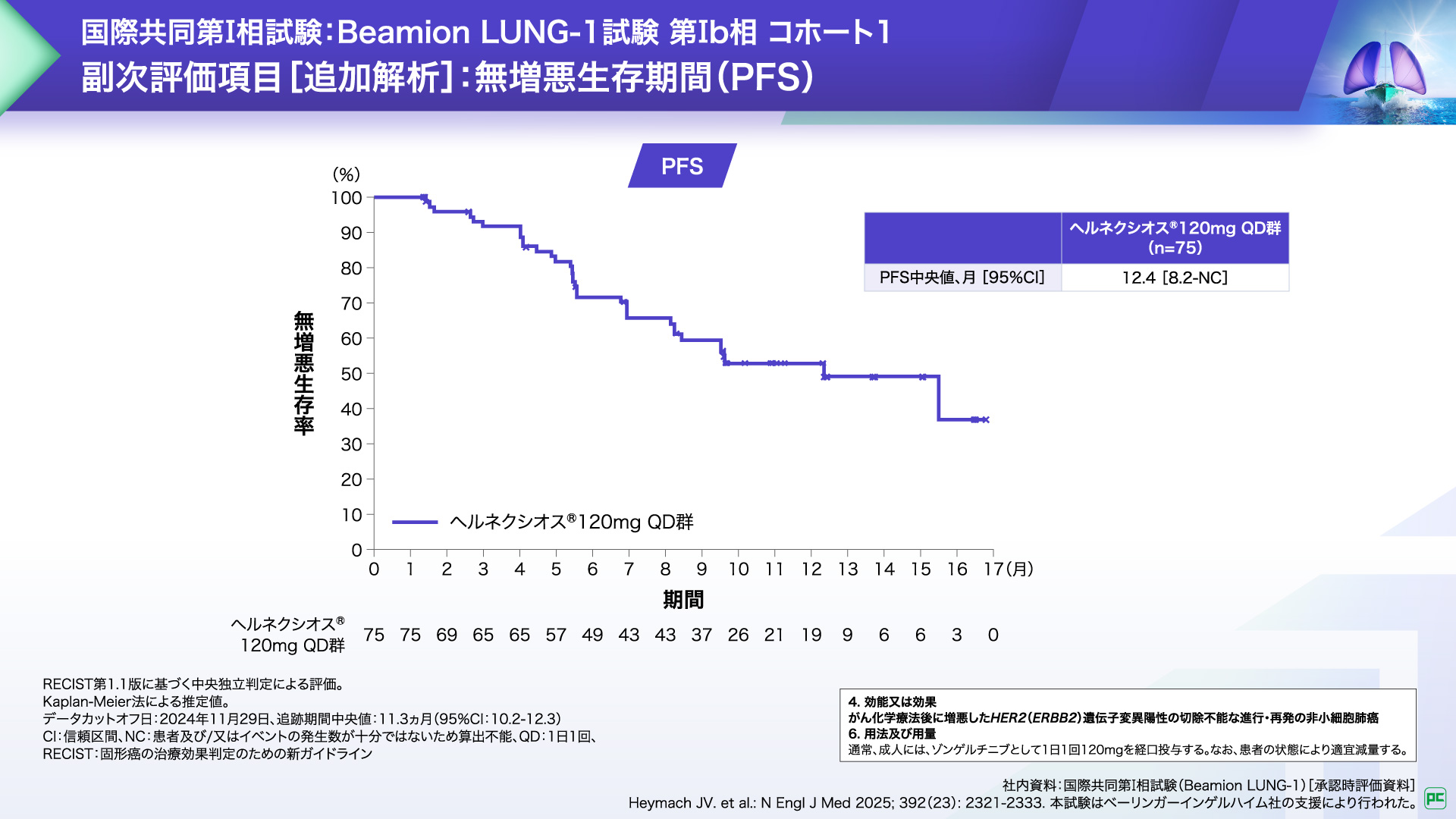
副次評価項目である無増悪生存期間(PFS)中央値は12.4ヵ月でした。
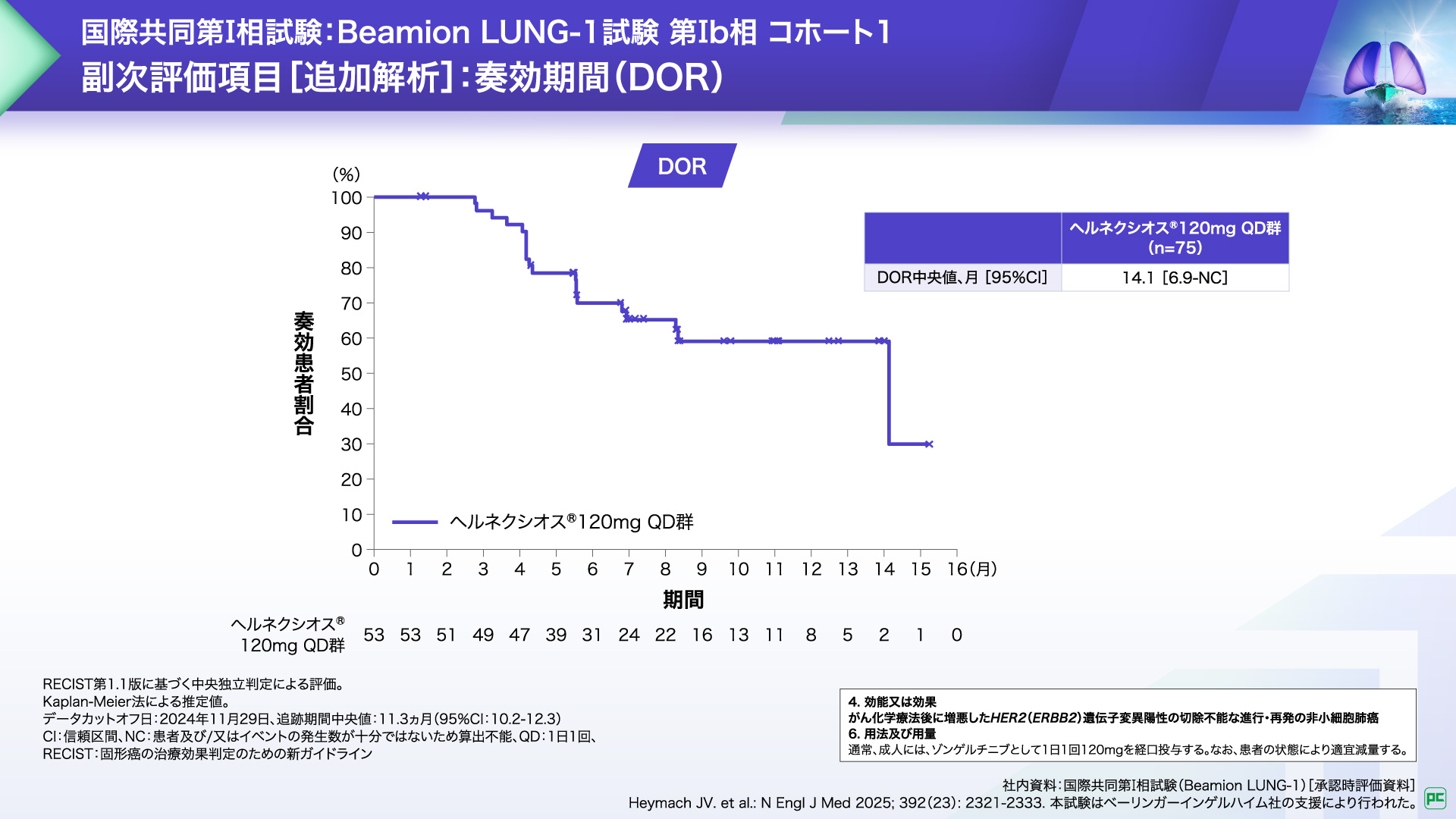
客観的奏効が認められた53例における奏効期間(DOR)中央値は14.1ヵ月でした。
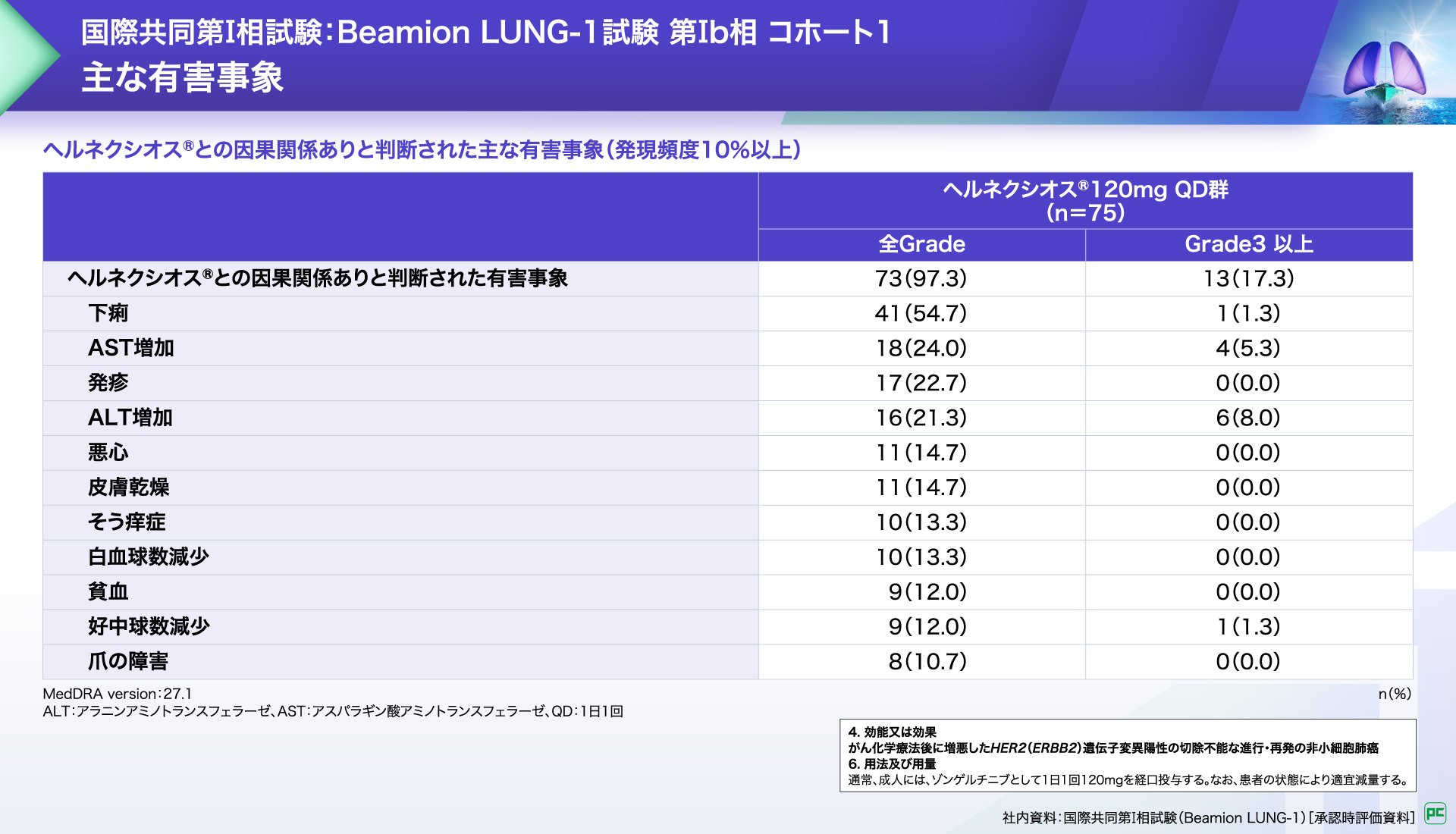
ヘルネクシオス®との因果関係ありと判断された有害事象は75例中73例、97.3%に認められました。
主な有害事象は下痢(54.7%)、AST増加(24.0%)、発疹(22.7%)、ALT増加(21.3%)などでした。
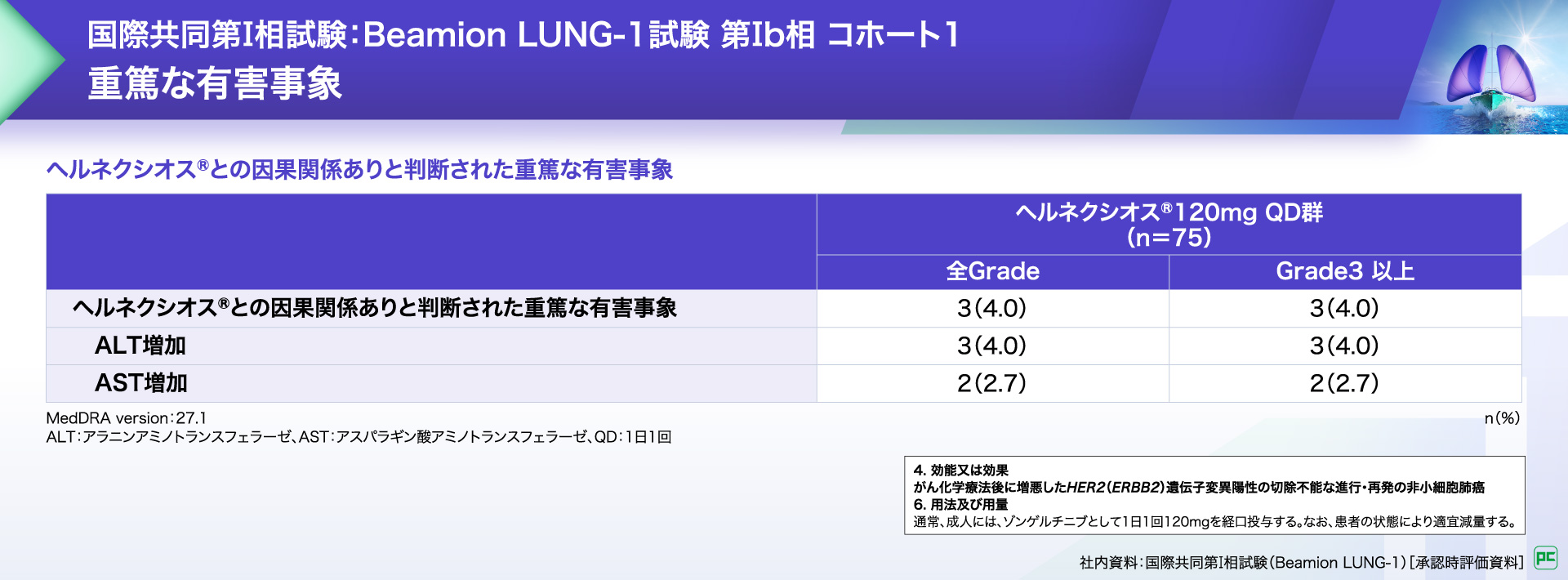
ヘルネクシオス®との因果関係ありと判断された重篤な有害事象は、3例(4.0%)に認められ、ALT増加、AST増加が報告されました。
ヘルネクシオス®との因果関係ありと判断された死亡に至った有害事象は報告がありませんでした。
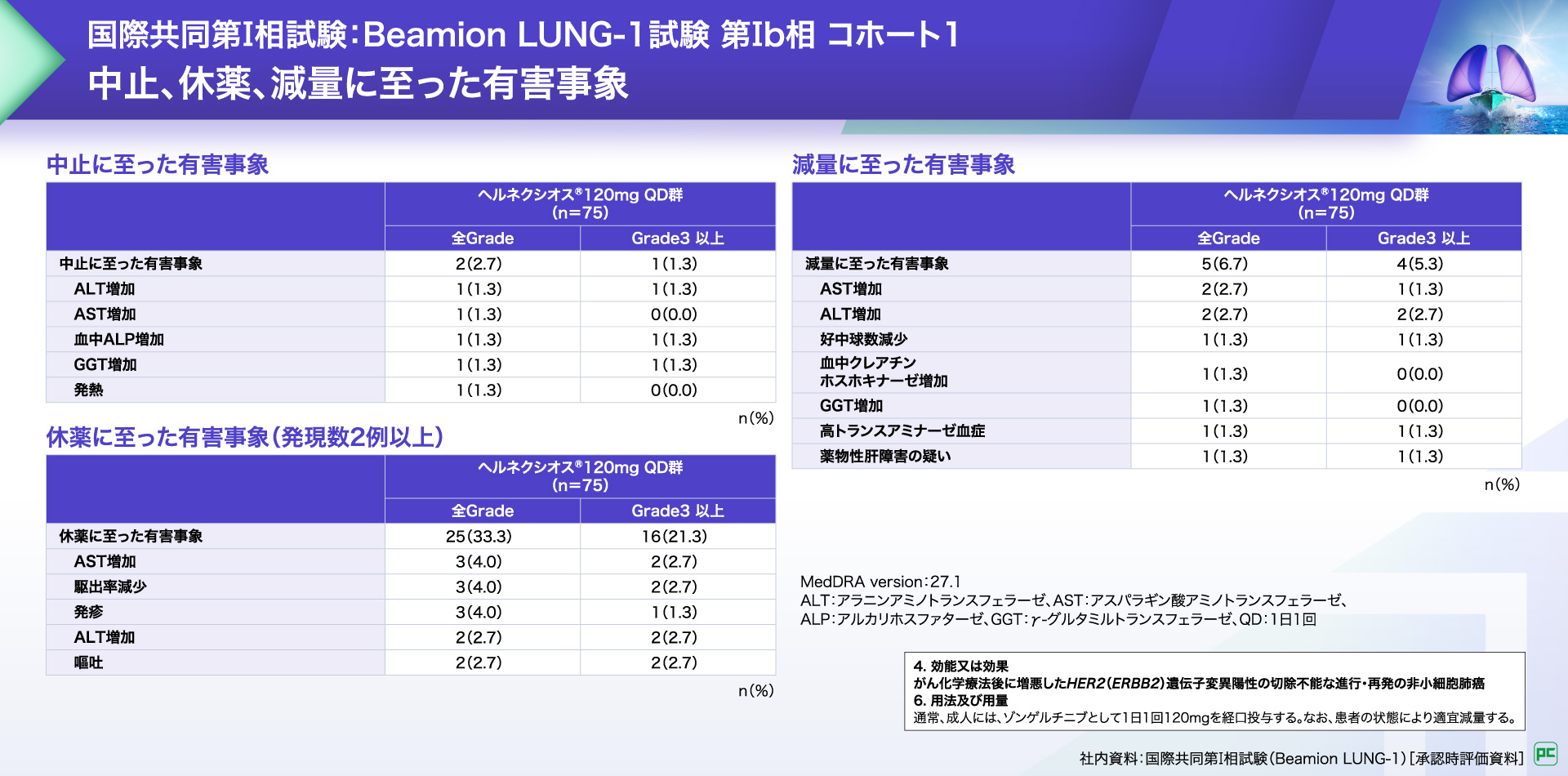
中止に至った有害事象は2例(2.7%)に認められ、ALT増加、AST増加、血中ALP増加、GGT増加及び発熱が報告されました。
休薬に至った有害事象は25例(33.3%)に認められ、2例以上にみられた有害事象はAST増加、駆出率減少、発疹、ALT増加及び嘔吐が報告されました。
減量に至った有害事象は5例(6.7%)に認められ、AST増加、ALT増加、好中球数減少、血中クレアチンホスホキナーゼ増加、GGT増加、高トランスアミナーゼ血症及び薬物性肝障害の疑いが報告されました。
【林先生のお言葉】
国内では、EGFR遺伝⼦変異陽性NSCLCに対するチロシンキナーゼ阻害剤(TKI)は2002年から使⽤可能でしたが、HER2遺伝⼦変異陽性NSCLCに対するTKIは⻑らく存在しておらず、治療の選択肢が限られていることに課題を感じていました。 このたび、ヘルネクシオス®がHER2遺伝⼦変異陽性NSCLCに対する初の経⼝TKIとして登場し、新たな治療選択肢を提供することとなりました。 本剤は、ERBBファミリーの中でも特にHER2に対して⾼い親和性を持ち、腫瘍増殖に関わるシグナル伝達を効果的に阻害する化学構造を有しています。 臨床試験であるBeamion LUNG-1試験では、客観的奏効率(ORR)が主解析で66.7%、追加解析で70.7%であり、無増悪⽣存期間(PFS)中央値は12.4ヵ⽉と1年を超えるデータが得られています。また、重篤な有害事象の発現率は4.0%であり、主な事象としてAST増加及びALT増加が報告されています。これを受けて、治療を中⽌した症例は全体の2.7%であることも確認されています。 この新たな治療選択肢により、HER2遺伝⼦変異陽性NSCLC患者の⽣活の質(QoL)を維持しながら、⻑期的な疾患進⾏の抑制が期待されます。
その他の関連情報

日本ベーリンガーインゲルハイム
メディカルチャット 利用規約
当社の「日本ベーリンガーインゲルハイム メディカルチャット」(以下「本サービス」といいます)のご利用に際しては、本利用規約が適用されますので、必ず以下の記載事項をご確認下さい。
利用規約
- 本サービスは、当社所定のウェブページから文字によりお問い合わせいただくことにより、当社医薬品等に関する一般的な情報を、人工知能あるいは当社担当者により、文字及び図表により回答するサービスです(以下、人工知能による回答サービスを「AIチャット」、当社担当者による回答サービスを「有人チャット」といいます。)。ただし、AIチャットによる回答を原則とし、有人チャットは、AIチャットでの回答に対し、有人チャットでの回答も希望された場合に、提供させていただきます。
- 本サービスをご利用いただくことができるのは、当社医薬品等を扱いかつ国内に在住する医療関係者の方に限られます。当該医療関係者以外の方は、ご利用いただくことができません。
- 本利用規約に同意いただけない場合、本サービスを利用いただくことができません。本利用規約を最後までお読みいただき、「同意して利用する」ボタンを押した上で、本サービスをご利用下さい。
- 本サービスは、当社医薬品等に関する一般的なお問い合わせに対して回答するものとし、次の各号に掲げるお問い合わせについては、回答しないものとします。
- 当社医薬品等と関係のないお問い合わせ、または本サービスの回答範囲を逸脱したお問い合わせ
- 具体的な症状や治療方法に関するお問合せ
- 当社に適用される法令、ガイドラインまたは行政上の指導、当社自主規制その他当社が遵守すべきルールにより回答できないお問い合わせ
- 文字化け等により入力内容が判断できないお問い合わせ
- 前各号に掲げるほか、本サービスにより、適切な回答をすることができないと当社が判断した事項に関するお問い合わせ
- 本サービスは、日本語のみに対応しています。
- 本サービスは、当社医薬品の副作用、不具合及び有害事象の報告を受け付けていません。
- お問い合わせの内容によっては、本サービスでは十分に回答できない場合もございます。予めご了承下さい。
- 本サービスの利用可能時間は、以下のとおりです。
- AIチャット
24時間365日 - 有人チャット
平日9:00~17:00
- AIチャット
- 前項に関わらず、メンテナンス及び障害等のため一時的に本サービスを中断する場合がございます。
本サービスのご利用の際には、原則として、個人情報(お名前、ご住所、電話番号、メールアドレス等)を入力しないようお願いします。ただし、AIチャット及び有人チャットを問わず、当社医薬品の適用外使用に関するお問い合わせについては、コンプライアンス上の理由により、当社より、氏名及び施設名の入力を求める場合がございます。この場合には、当社プライバシーポリシーの内容を確認いただき、同意いただける場合に限り、入力して下さい(プライバシーポリシーについては「VIII 利用規約、プライバシーポリシー」に記載のURLからアクセス下さい)。その他の場合に、当社より個人情報の入力を求めることは一切ございません。
- 当社医薬品のご使用にあたっては、最新の添付文書等をご確認下さい。
- 当社は、本サービスまたは本サービスにより提供される情報の利用に際し生じた結果については、一切責任を負いません。
本サービスの利用にあたり、以下の各号の行為を禁止します。
- 本サービスにより提供される情報を複製、複写、転載、改変等する行為
- 第三者または当社の知的財産権その他の権利を侵害する行為
- 第三者または当社を誹謗中傷し、または名誉・信用を毀損する行為
- 本サービスの利用による営利目的の行為
- 本サービスの運営又は他の利用者による本サービスの利用の妨げとなる行為
- 前各号のほか、当社が不適当であると判断する行為
当社は、いつでも本サービスの提供を終了、またはその内容を変更することができるものとします。
本サービスの利用に関しては、以下の利用規約及びプライバシーポリシーが併せて適用されますので、ご確認下さい。




