
Effisayil-1試験の試験デザイン
サイトへ公開:2022年09月26日 (月)
クイックリンク

監修:
本間 大 先生
旭川医科大学 国際医療支援センター 教授
はじめに
膿疱性乾癬(GPP)は、急性症状が時に生命を脅かすこともある希少疾患です。「膿疱性乾癬(汎発型)診療ガイドライン2014年度版」に「膿疱性乾癬(汎発型)は症例数が少なく、重症度が高いことから大規模な比較試験などのエビデンスレベルの高い検討は困難である」1)とされているとおり、その疾患特性のため、二重盲検無作為化試験による治療薬の効果検証が困難だと考えられてきました。実際に、従来わが国でGPPの治療に用いられてきた薬剤は、少数例に対する非盲検、単一用量試験の結果に基づいて承認されています。
2022年9月に承認されたGPPの治療薬であるスペビゴ®は、GPPの急性症状が認められる患者を対象に行われた初めての二重盲検無作為化試験であるEffisayilᵀᴹ 1試験において有効性が検証されました2)3)。
Effisayilᵀᴹ1試験の試験デザインの特徴
Effisayilᵀᴹ1試験は、世界12ヵ国(37施設)から登録された中等度から重度の急性症状が認められるGPP患者53例を対象に行われました。GPPは希少疾患であり的確な患者数が限られています。Effisayilᵀᴹ1試験においては、スペビゴ®の安全性に関するデータ集積の向上を実現するために2:1の不均衡割り付けが行われ、内訳はスペビゴ®群35例に対しプラセボ群が18例となっています(図1)。
登録患者のスクリーニング時のGPPの診断は、European Rare And Severe Psoriasis Expert Network(ERASPEN、欧州の希少で重度の乾癬専門家ネットワーク)が定めるコンセンサス診断基準に基づいて行われました(表1)。ERASPENの基準では、GPPの診断にあたって全身の炎症症状の有無は問われていないため、Effisayilᵀᴹ1試験では皮膚症状によって患者登録が選択されました。なお、日本から参加した2例の患者は、ERASPEN診断基準に加えて、日本皮膚科学会「膿疱性乾癬(汎発型)診療ガイドライン」1)の診断基準に基づいて、GPPの既往の有無を確認しています(表1)。


Effisayilᵀᴹ1試験の評価に用いられた指標の特徴
GPP患者を対象に行われた臨床試験であるEffisayilᵀᴹ1試験の特徴の1つに、重症度評価にGPPに特化した指標が用いられていることが挙げられます。
スペビゴ®の臨床試験開始以前には、GPPに特化した重症度評価指標は存在していませんでした。ベーリンガーインゲルハイムが外部のGPP診療の専門家とともに、GPPに特化した新たな重症度評価指標として作成した指標がGPPGA(Generalized Pustular Psoriasis Physician Global Assessment、表2)とGPPASI(Generalized Pustular Psoriasis Area and Severity Index)*です。GPPGAは乾癬に対する医師の全般的評価(Physician's Global Assessment: PGA)を、GPPASIは乾癬における病巣範囲の程度の評価(Psoriasis Area and Severity Index: PASI)をもとに作成されました。GPPの皮膚病変の特徴をより反映させるため、乾癬の重症度評価における「肥厚」のコンポーネントは、GPPの主な特徴である「膿疱」に書き換えられています。Effisayilᵀᴹ1試験をはじめとするGPPを対象としたスペビゴ®の臨床試験において、GPPGA/GPPASIは一貫して重症度評価の指標として用いられています。
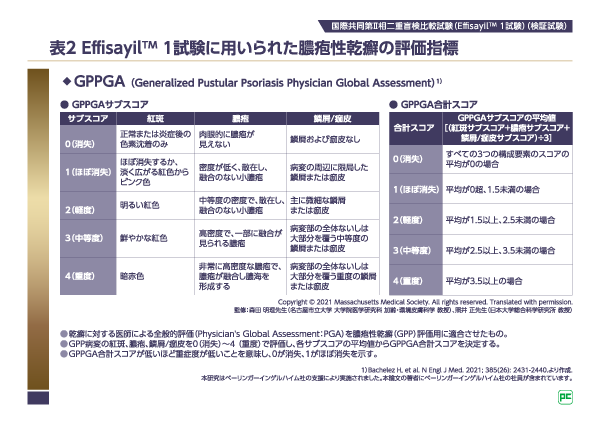
Effisayilᵀᴹ1試験においては、主要評価項目は1週時におけるGPPGA膿疱サブスコア0(肉眼的に膿疱が見えない)達成率、重要な副次評価項目は1週時におけるGPPGA合計スコア0/1(消失またはほぼ消失)達成率、階層型の統計学的手順に含まれる4つの副次評価項目の1つ目は4週時におけるGPPASIが75%以上減少(GPPASI 75)達成率が設定されました(図1)。
*GPPASI:汎発性膿疱性乾癬面積重症度指数。乾癬の重症度と面積の指標として確立されているPASI(Psoriasis Area and Severity Index)をGPP用に改変したもので、病変の状態を0~72でスコア化する。
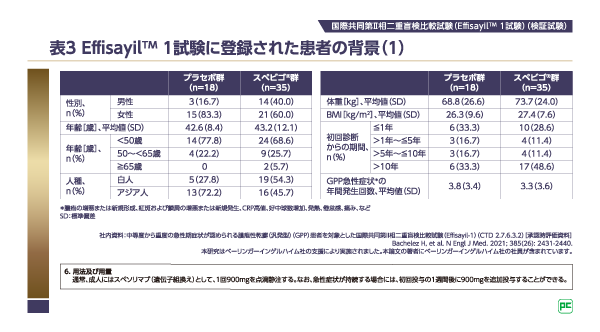
Effisayilᵀᴹ1試験にエントリーされた患者のベースライン特性
患者の選択基準(図1)に基づき、Effisayilᵀᴹ1試験のすべての登録患者は中等度から重度のGPPの急性症状が認められる患者です。Effisayilᵀᴹ1試験における中等度から重度のGPP急性症状の定義は、「GPPGA合計スコア3以上、GPPGA膿疱サブスコアが2以上、体表面積(BSA)の5%以上に及ぶ紅斑に膿疱を認める」でした。また、登録患者のGPPの罹病期間は初回診断から10年超の割合がスペビゴ®群で48.6%、プラセボ群で33.3%、GPPの急性症状の平均年間発生回数は、スペビゴ®群、プラセボ群両群ともに平均で3回を超えていることが確認されています(表3)。
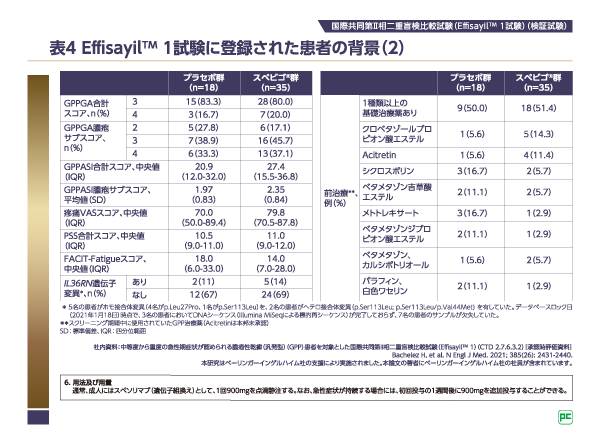
近年の遺伝学的検討により、GPP発症とIL-36Rを介したシグナル伝達経路の突然変異との関連性が示されており4)5)、GPP患者におけるIL36RN遺伝子変異の有無が注目されていますが、Effisayilᵀᴹ1試験に登録されたGPP患者の約7割においてIL36RN遺伝子変異は認められていません(表4)。主要評価項目、重要な副次評価項目、副次評価項目は、IL36RN遺伝子変異の有無別にサブグループ解析が行われており、臨床の観点からは注目される結果の1つであるといえます。
おわりに
Effisayilᵀᴹ1試験という、急性症状が認められるGPP患者を対象とした初めてのプラセボ対照二重盲検比較試験が実施されたことは、症状に苦しむ患者の身体的・精神的負担の解消を目指したGPP治療の実現に向けて意義あることだと考えられます。Effisayilᵀᴹ1試験の結果が、今後のさらなるGPPの病態解明や治療の充実へとつながっていくことを期待したいと思います。
References
- 日本皮膚科学会膿疱性乾癬(汎発型)診療ガイドライン作成委員会. 膿疱性乾癬(汎発型)診療ガイドライン2014年度版. 日皮会誌. 2015; 125(12): 2211-2257.
- 社内資料:中等度から重度の急性期症状が認められる膿疱性乾癬(汎発型)(GPP)患者を対象とした国際共同第II相二重盲検比較試験(Effisayilᵀᴹ 1試験)(CTD 2.7.6.3.2)[承認時評価資料]
- Bachelez H, et al. N Engl J Med. 2021; 385(26): 2431-2440.
本研究はベーリンガーインゲルハイム社の支援により実施されました。本論文の著者にベーリンガーインゲルハイム社の社員が含まれています。 - Marrakchi S, et al. N Engl J Med 2011; 365(7): 620-628.
- Onoufriadis A, et al. Am J Hum Genet 2011; 89(3): 432-437.
その他の関連情報

日本ベーリンガーインゲルハイム
メディカルチャット 利用規約
当社の「日本ベーリンガーインゲルハイム メディカルチャット」(以下「本サービス」といいます)のご利用に際しては、本利用規約が適用されますので、必ず以下の記載事項をご確認下さい。
利用規約
- 本サービスは、当社所定のウェブページから文字によりお問い合わせいただくことにより、当社医薬品等に関する一般的な情報を、人工知能あるいは当社担当者により、文字及び図表により回答するサービスです(以下、人工知能による回答サービスを「AIチャット」、当社担当者による回答サービスを「有人チャット」といいます。)。ただし、AIチャットによる回答を原則とし、有人チャットは、AIチャットでの回答に対し、有人チャットでの回答も希望された場合に、提供させていただきます。
- 本サービスをご利用いただくことができるのは、当社医薬品等を扱いかつ国内に在住する医療関係者の方に限られます。当該医療関係者以外の方は、ご利用いただくことができません。
- 本利用規約に同意いただけない場合、本サービスを利用いただくことができません。本利用規約を最後までお読みいただき、「同意して利用する」ボタンを押した上で、本サービスをご利用下さい。
- 本サービスは、当社医薬品等に関する一般的なお問い合わせに対して回答するものとし、次の各号に掲げるお問い合わせについては、回答しないものとします。
- 当社医薬品等と関係のないお問い合わせ、または本サービスの回答範囲を逸脱したお問い合わせ
- 具体的な症状や治療方法に関するお問合せ
- 当社に適用される法令、ガイドラインまたは行政上の指導、当社自主規制その他当社が遵守すべきルールにより回答できないお問い合わせ
- 文字化け等により入力内容が判断できないお問い合わせ
- 前各号に掲げるほか、本サービスにより、適切な回答をすることができないと当社が判断した事項に関するお問い合わせ
- 本サービスは、日本語のみに対応しています。
- 本サービスは、当社医薬品の副作用、不具合及び有害事象の報告を受け付けていません。
- お問い合わせの内容によっては、本サービスでは十分に回答できない場合もございます。予めご了承下さい。
- 本サービスの利用可能時間は、以下のとおりです。
- AIチャット
24時間365日 - 有人チャット
平日9:00~17:00
- AIチャット
- 前項に関わらず、メンテナンス及び障害等のため一時的に本サービスを中断する場合がございます。
本サービスのご利用の際には、原則として、個人情報(お名前、ご住所、電話番号、メールアドレス等)を入力しないようお願いします。ただし、AIチャット及び有人チャットを問わず、当社医薬品の適用外使用に関するお問い合わせについては、コンプライアンス上の理由により、当社より、氏名及び施設名の入力を求める場合がございます。この場合には、当社プライバシーポリシーの内容を確認いただき、同意いただける場合に限り、入力して下さい(プライバシーポリシーについては「VIII 利用規約、プライバシーポリシー」に記載のURLからアクセス下さい)。その他の場合に、当社より個人情報の入力を求めることは一切ございません。
- 当社医薬品のご使用にあたっては、最新の添付文書等をご確認下さい。
- 当社は、本サービスまたは本サービスにより提供される情報の利用に際し生じた結果については、一切責任を負いません。
本サービスの利用にあたり、以下の各号の行為を禁止します。
- 本サービスにより提供される情報を複製、複写、転載、改変等する行為
- 第三者または当社の知的財産権その他の権利を侵害する行為
- 第三者または当社を誹謗中傷し、または名誉・信用を毀損する行為
- 本サービスの利用による営利目的の行為
- 本サービスの運営又は他の利用者による本サービスの利用の妨げとなる行為
- 前各号のほか、当社が不適当であると判断する行為
当社は、いつでも本サービスの提供を終了、またはその内容を変更することができるものとします。
本サービスの利用に関しては、以下の利用規約及びプライバシーポリシーが併せて適用されますので、ご確認下さい。


