GPPの病態形成におけるIL-36による炎症誘導とは
サイトへ公開:2024年10月30日 (水)
クイックリンク

監修:
澤田 雄宇 先生
産業医科大学医学部 皮膚科学教室 教授
1.はじめに
膿疱性乾癬(generalized pustular psoriasis; GPP)は、急激な発熱、倦怠感、浮腫といった全身症状とともに全身の皮膚が潮紅し、無菌性膿疱が多発する疾患で、再発を繰り返すことが特徴です。GPPの臨床症状や急性症状の重症度は多岐にわたりますが、適切な治療がなされなかった場合、敗血症、腎不全、呼吸不全などを併発し、生命を脅かす可能性もあります1)。
GPPは自然免疫の関与が一因として知られている自己炎症疾患で、GPPに特徴的な無菌性膿疱の形成は好中球、T細胞、樹状細胞、単球などの自然免疫系の細胞を活性化させるIL-36を介したシグナル伝達によって引き起こされると考えられています2)3)。
GPPの急性症状は生命に関わる場合もあるため、早期診断・早期治療が重要となります。ここでは、GPPの病態におけるIL-36シグナル伝達経路の役割を解説するとともに、中等度から重度の急性症状*1が認められる患者さんを対象に行われたEffisayilTM 1試験よりヒト化抗ヒトIL-36レセプターモノクローナル抗体製剤であるスペビゴ®の有効性・安全性を紹介します。
*1 EffisayilTM 1試験における中等度から重度のGPP急性症状の定義:
GPPGA合計スコア3(中等度)以上、および/ 新たな膿疱の存在(膿疱の新規形成または増悪)、および/ GPPGA膿疱サブスコア2(軽度)以上、および/ 体表面積(BSA)の5%以上に及ぶ紅斑に膿疱を有する
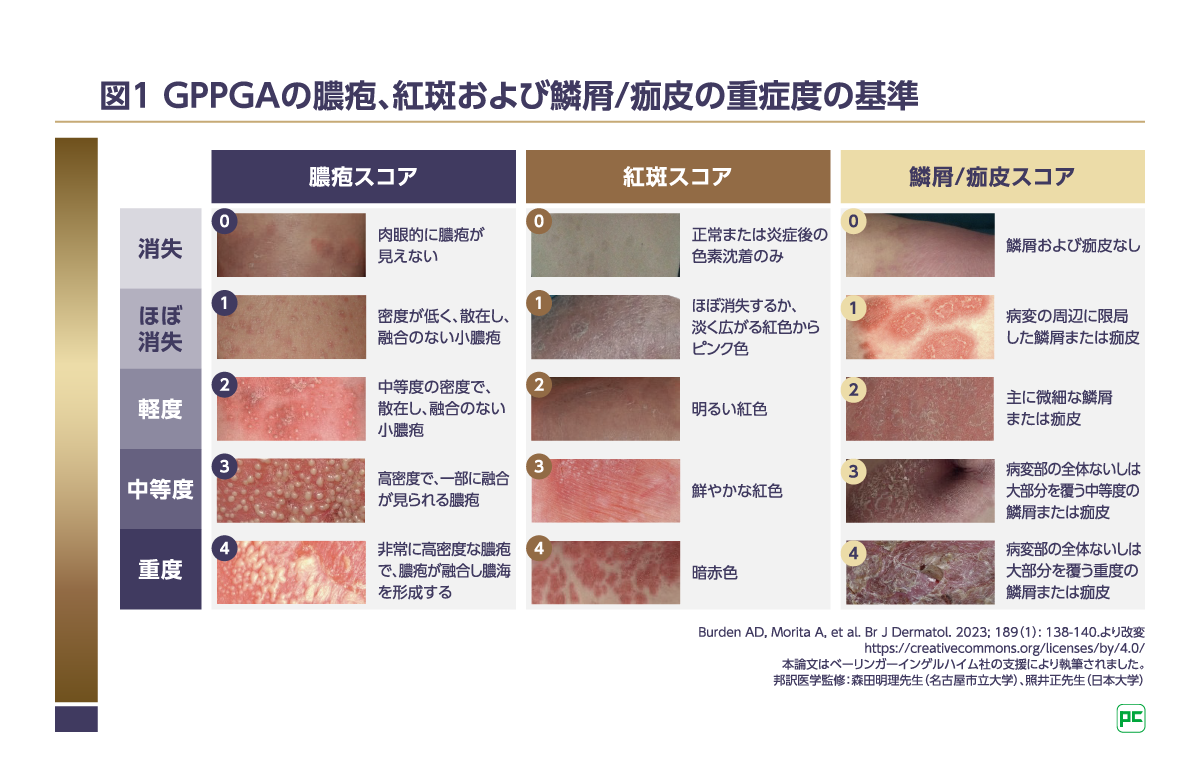
[参考]GPPGA(膿疱性乾癬に対する医師による全般的評価[Generalized Pustular Psoriasis Physician Global Assessment])では、すべての病変に対して各構成要素を評価し、各構成要素の重症度は5段階尺度で評価されます(図1)。GPPGA合計スコアは、すべてのGPP病変の膿疱、紅斑、鱗屑/痂皮を0(消失)~4(重度)で評価し、各構成要素のスコア(サブスコア)の平均値[(膿疱サブスコア+紅斑サブスコア+鱗屑/痂皮サブスコア)÷3]から算出します。
2.IL-36による炎症反応の誘導
IL-36シグナル伝達を誘導するIL-36は、IL-1ファミリーに属するサイトカインの一種であり、ケラチノサイトを含む様々な細胞で発現しています。IL-36にはIL-36α、IL-36β、IL-36γという3つの異なるアイソフォームがあり、ストレス、薬物、外傷、喫煙、病原体などの刺激をトリガーとしてケラチノサイトから放出され、細胞外にあるプロテアーゼにより活性化されます4)。活性化されたIL-36がIL-36受容体(IL-36R)に結合すると、MAPキナーゼ(MAPK)やNF-κBを介して炎症性サイトカインやケモカインが誘導され、樹状細胞や好中球などの免疫細胞が活性化します5)。
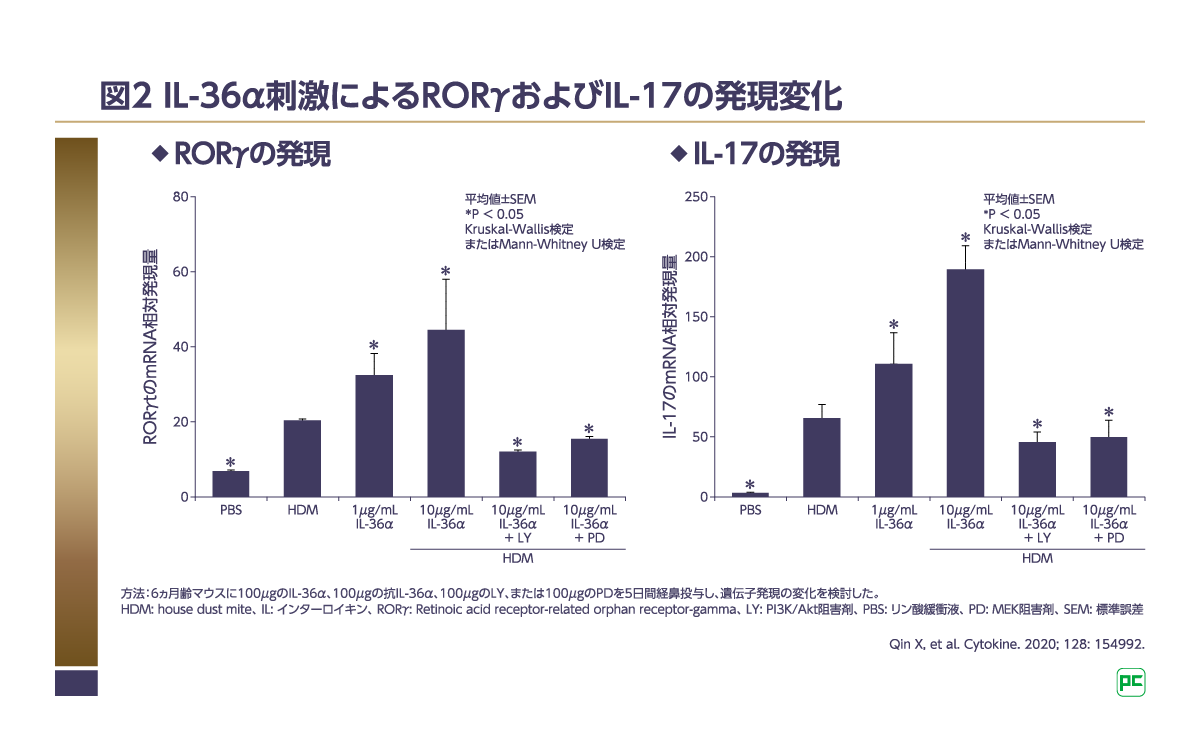
マウスの末梢血単核細胞(peripheral blood mononuclear cell; PBMC)を用いて、IL-36α刺激がTh17細胞に関連する遺伝子発現に及ぼす影響を検討した研究が行われました6)。その結果、IL-36α刺激により、Th17細胞の転写因子であるRORγやIL-17の発現増加が認められました(図2)6)。
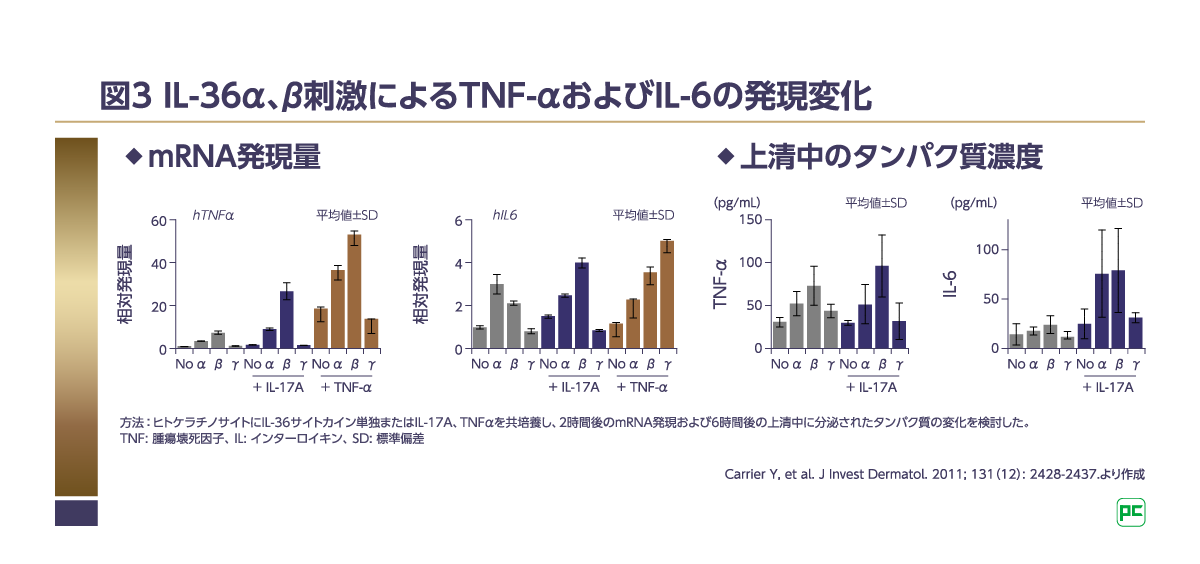
また、ヒトのPBMCを用いて、IL-36α刺激によるTh17細胞に関連する遺伝子の発現変化を検討した研究では、刺激後2時間でTNF-αおよびIL-6のmRNA量が増加し、刺激後6時間でそれぞれのタンパク量が増加していることが示されました7)。さらにIL-17、TNF-α存在下では、TNF-αおよびIL-6の発現増加が認められました(図3)7)。以上の結果から、IL-36によって誘導されたIL-17AおよびTNF-αは、さらなる炎症反応を誘導すると考えられます7)。
3.GPPの病態形成におけるIL-36シグナル伝達経路の役割
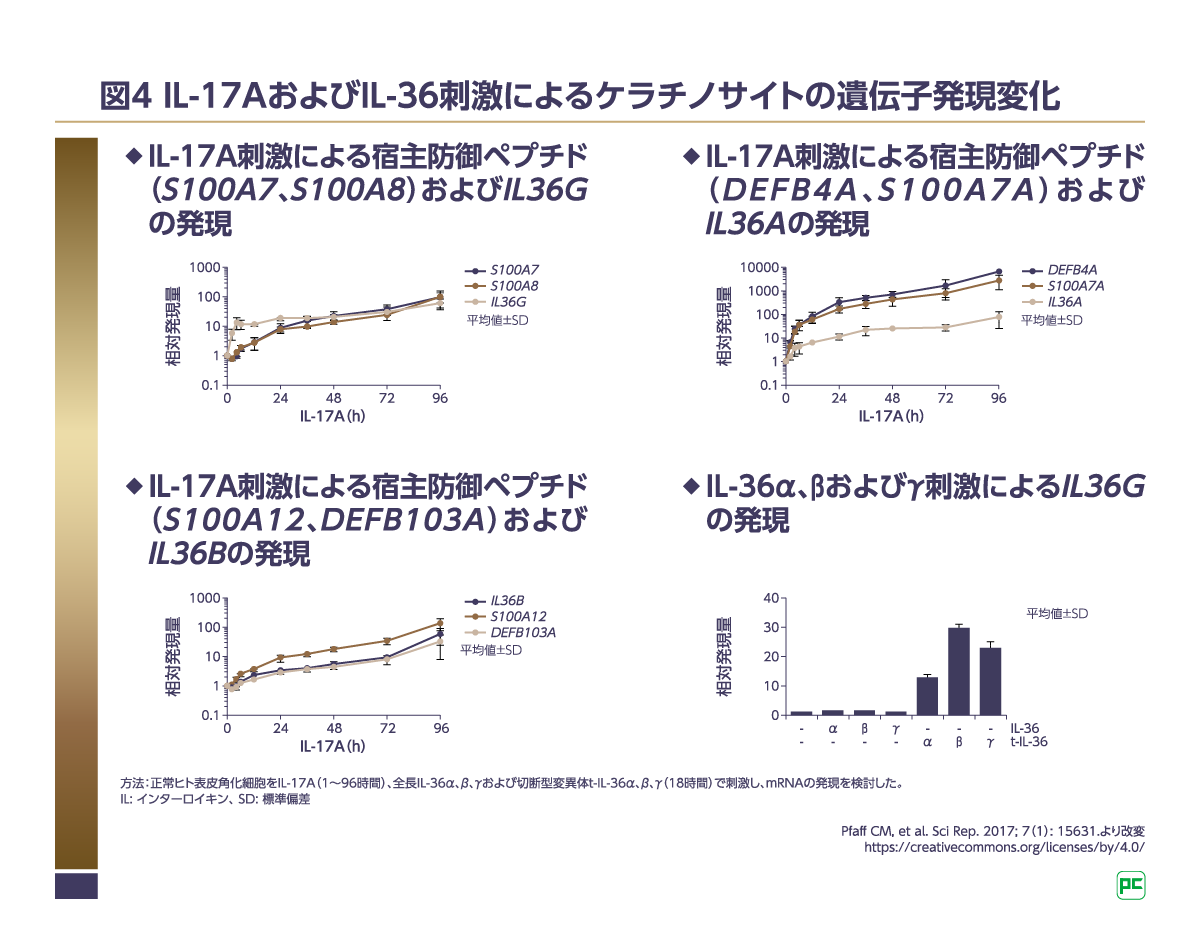
ケラチノサイトはサイトカインなどを介して免疫細胞とクロストークしていることが知られています8)。ヒトケラチノサイトを用いて、IL-17A、IL-36刺激による遺伝子発現の変化を検討した研究が行われました9)。ヒトケラチノサイトをIL-17Aで刺激した結果、IL-36をコードする遺伝子IL36A、IL36B、IL36Gの発現増加が認められました(図4)9)。さらに、IL-36α、β、γ刺激によるIL36Gの発現を検討したところ、活性を示すIL-36α、β、γの切断型変異体を加えたケラチノサイトにおいて、IL36Gの発現増加が認められました(図4)9)。以上の結果から、IL-36はIL-17Aシグナルと協調し、持続的な炎症を促進する増幅メカニズムを有することが示唆されます9)。
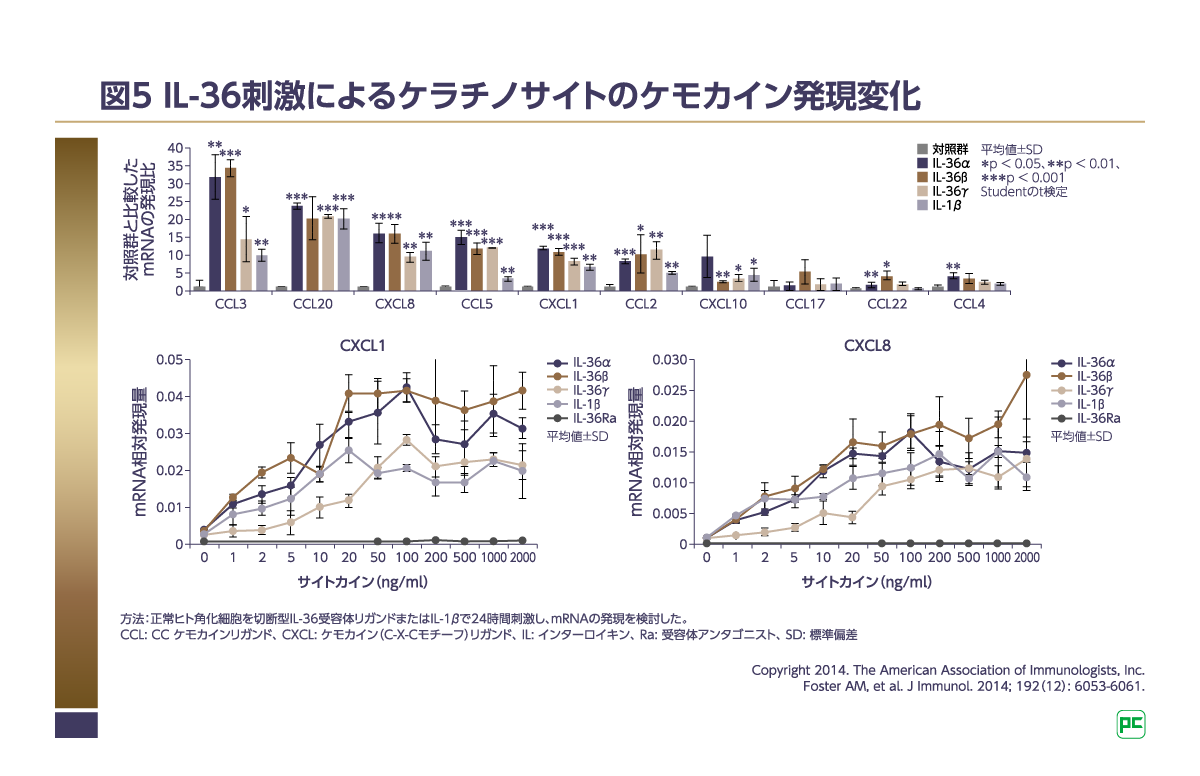
また、ヒトケラチノサイトを用いて、IL-36刺激によるケモカイン産生を検討した研究では、IL-36α、β、γを加えたケラチノサイトで白血球の遊走を誘導するCXCL1、CXCL8、CCL3、CCL5、およびCCL20の発現増加が認められました(図5)10)。さらにCXCL1、CXCL8の発現はIL-36濃度依存的に増加したことも示されています(図5)10)。
これらの結果はIL-36で刺激されたケラチノサイトが免疫細胞の遊走を誘導するケモカインを産生することを示唆しており10)、IL-36を介したケモカインの産生によりGPPの病態形成が誘導されると考えられます。
4.急性症状に対するスペビゴ®の臨床成績
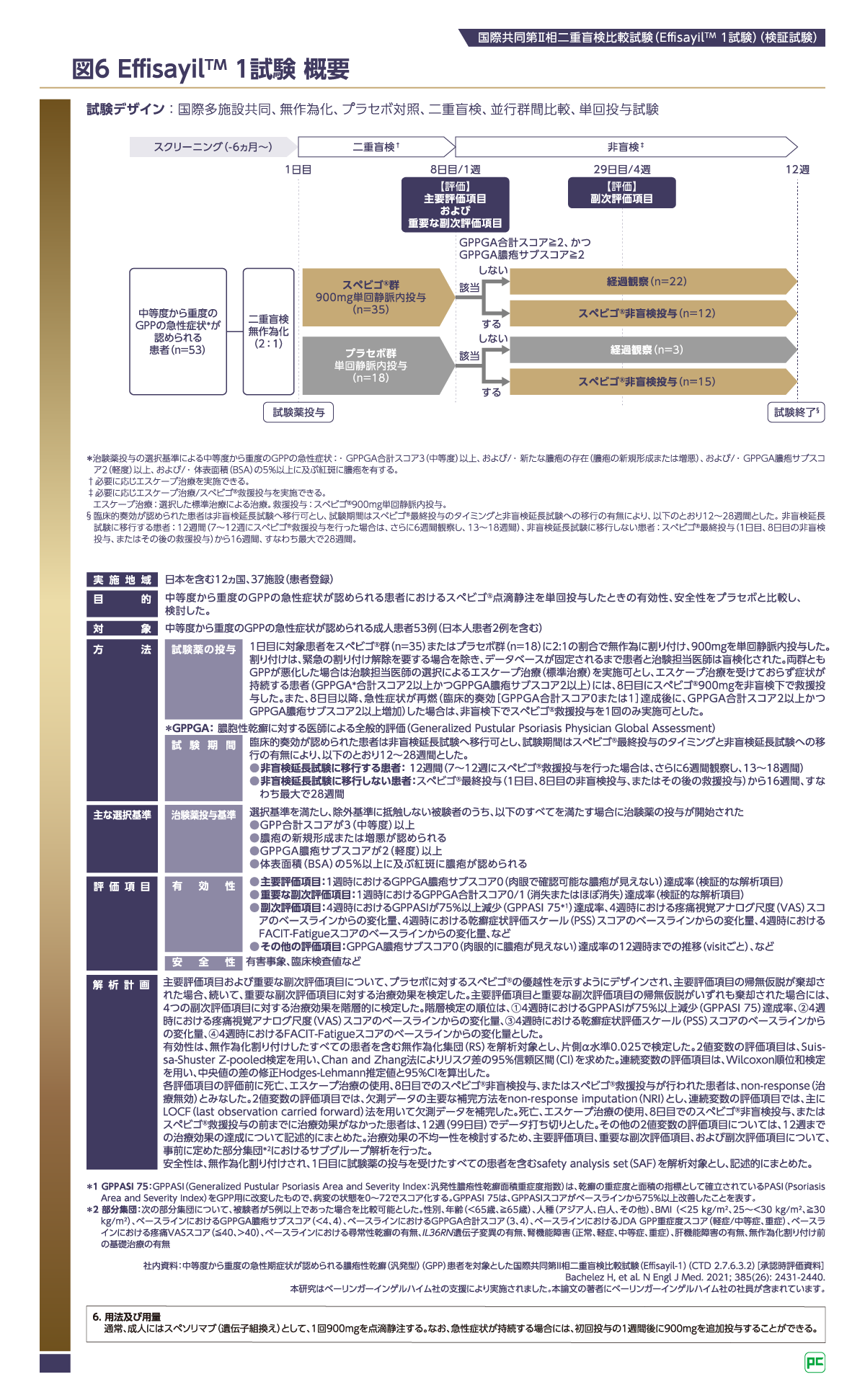
4-1)試験デザイン
EffisayilTM 1試験は、急性症状を有するGPP患者さんを対象に行われた初めての二重盲検無作為化比較試験です11)12)。日本人患者2例を含む対象患者53例を、スペビゴ®群2に対しプラセボ群1の割合で割付け(図6)、900mgを単回静脈内投与しました。両群ともGPPが悪化した場合は治験担当医師の選択によるエスケープ治療(標準治療)を実施可とし、エスケープ治療を受けておらず症状が持続する患者(GPPGA合計スコア2以上かつGPPGA膿疱サブスコア2以上)には、8日目にスペビゴ® 900mgを非盲検下で救援投与しました。また、8日目以降、急性症状が再燃(臨床的奏効[GPPGA合計スコア0または1]達成後に、GPPGA合計スコア2以上かつGPPGA膿疱サブスコア2以上増加)した場合は、非盲検下でスペビゴ®救援投与を1回のみ実施可としました。
主要評価項目(検証的な解析項目)は「1週時におけるGPPGA膿疱サブスコア0(肉眼的に膿疱が見えない)達成率」、重要な副次評価項目(検証的な解析項目)は「1週時におけるGPPGA合計スコア0/1(消失またはほぼ消失)達成率」です。なお、EffisayilTM 1試験を含むGPP患者を対象としたすべてのスペビゴ®の臨床試験で、GPPに特化した重症度評価指標として新たに作成されたGPPGA/GPPASI*2が用いられています(図6)。
*2 GPPASI:汎発性膿疱性乾癬面積重症度指数(Generalized Pustular Psoriasis Area and Severity Index)。乾癬の重症度と面積の指標として確立されているPASI(Psoriasis Area and Severity Index)をGPP用に適合させたもの。GPPASI病変の状態を0~72でスコア化している。
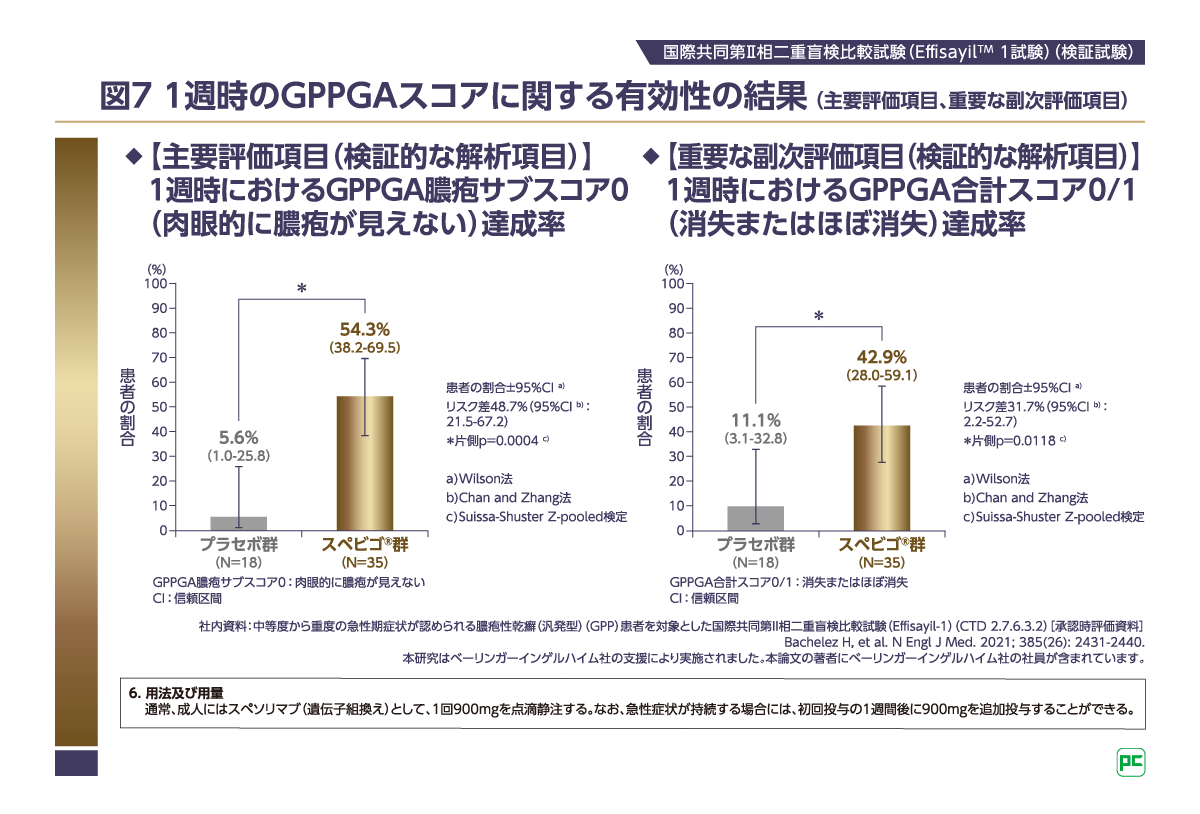
4-2)EffisayilTM 1試験の臨床成績
主要評価項目(1週時のGPPGA膿疱サブスコア0達成率:スペビゴ®群54.3%[19/35例]、プラセボ群5.6%[1/18例])、重要な副次評価項目(1週時のGPPGA合計スコア0/1達成率:スペビゴ®群42.9%[15/35例]、プラセボ群11.1%[2/18例])において、スペビゴ®群はプラセボ群に比べて1週時における膿疱および皮膚症状の有意な改善が認められました(それぞれ片側p=0.0004、片側p=0.0118、いずれもSuissa-Shuster Z-pooled検定、検証的な解析項目。図7)。
4-3)EffisayilTM 1試験の安全性
EffisayilTM 1試験では、1週時と12週時に安全性の評価を行っています。
1週時までに、スペビゴ®群12例(34.3%)、プラセボ群6例(33.3%)に副作用が発現しました。主な副作用は、スペビゴ®群では膿疱性乾癬5例(14.3%)、末梢性浮腫2例(5.7%)、プラセボ群では膿疱性乾癬3例(16.7%)、末梢性浮腫1例(5.6%)でした。
1週時までに発現した重篤な有害事象はスペビゴ®群で5例(14.3%)、プラセボ群で3例(16.7%)に発現しました。内訳は、スペビゴ®群が膿疱性乾癬4例(11.4%)、好酸球増加および全身症状を伴う薬物反応、尿路感染、薬剤性肝障害および関節炎が各1例(2.9%)、プラセボ群が膿疱性乾癬3例(16.7%)でした。
投与中止に至った有害事象、死亡に至った有害事象は報告されませんでした(表1)。

5.おわりに
本稿ではIL-36シグナル伝達経路により、免疫細胞やケラチノサイトが活性化され、ケラチノサイトにおける炎症性サイトカインや好中球ケモカイン、リンホカインの発現が誘導されることをご紹介しました。
GPPの急性症状は生命を脅かすだけでなく、患者さんのQOLを損なう要因の1つでもあるので、早期診断・早期治療が重要となります。そのためには、患者さんが急性症状の兆候となる症状を我慢してしまったり、急性症状が現れた時に受診を躊躇してしまったりしないようにサポートすることが必要だと考えます。産業医科大学では、GPPと診断した時に、疾患に関する説明に加えて、体調の変化を感じた際は医局もしくは教授宛てに直接ご連絡いただくよう、患者さんやご家族へお伝えしています。
GPPは症状や合併症に多様性があるため、各患者さんの病態に即した治療を選択することが重要です。急性症状を有するGPP患者を対象に行われた初めての二重盲検無作為化比較試験であるEffisayilTM 1試験ではスペビゴ®投与により投与1週時点の膿疱および皮膚症状がプラセボに比べて有意に改善したことが報告されました。EffisayilTM 1試験で示されたデータを踏まえると、GPPの主要炎症経路であるIL-36を直接的に遮断するスペビゴ®は、GPPの急性症状に対する選択肢の1つになると考えられます。
References
- 日本皮膚科学会膿疱性乾癬(汎発型)診療ガイドライン作成委員会. 膿疱性乾癬(汎発型)診療ガイドライン2014年度版. 日皮会誌. 2015; 125(12): 2211-2257.
- Schön MP, Erpenbeck L. Front Immunol. 2018; 9: 1323.
- Marrakchi S, et al. Am J Clin Dermatol. 2022; 23(Suppl 1): 13-19.
(著者にベーリンガーインゲルハイム社より講演料、コンサルタント料等を受領している者が含まれます。) - Samotij D. et al. Int J Mol Sci. 2021; 22(16): 9048.
- Queen D, et al. Front Cell Dev Biol. 2019; 7: 317.
- Qin X, et al. Cytokine. 2020; 128: 154992.
- Carrier Y, et al. J Invest Dermatol. 2011; 131(12): 2428-2437.
- Piipponen M, et al. Int J Mol Sci. 2020; 21(22): 8790.
- Pfaff CM, et al. Sci Rep. 2017; 7(1): 15631.
- Foster AM, et al. J Immunol. 2014; 192(12): 6053-6061.
- 社内資料:中等度から重度の急性期症状が認められる膿疱性乾癬(汎発型)(GPP)患者を対象とした国際共同第Ⅱ相二重盲検比較試験(Effisayil-1試験)(CTD 2.7.6.3.2)[承認時評価資料]
- Bachelez H, et al. N Engl J Med. 2021; 385(26): 2431-2440.
(本研究はベーリンガーインゲルハイム社の支援により実施されました。本論文の著者にベーリンガーインゲルハイム社の社員が含まれています。)
日本ベーリンガーインゲルハイム
メディカルチャット 利用規約
当社の「日本ベーリンガーインゲルハイム メディカルチャット」(以下「本サービス」といいます)のご利用に際しては、本利用規約が適用されますので、必ず以下の記載事項をご確認下さい。
利用規約
- 本サービスは、当社所定のウェブページから文字によりお問い合わせいただくことにより、当社医薬品等に関する一般的な情報を、人工知能あるいは当社担当者により、文字及び図表により回答するサービスです(以下、人工知能による回答サービスを「AIチャット」、当社担当者による回答サービスを「有人チャット」といいます。)。ただし、AIチャットによる回答を原則とし、有人チャットは、AIチャットでの回答に対し、有人チャットでの回答も希望された場合に、提供させていただきます。
- 本サービスをご利用いただくことができるのは、当社医薬品等を扱いかつ国内に在住する医療関係者の方に限られます。当該医療関係者以外の方は、ご利用いただくことができません。
- 本利用規約に同意いただけない場合、本サービスを利用いただくことができません。本利用規約を最後までお読みいただき、「同意して利用する」ボタンを押した上で、本サービスをご利用下さい。
- 本サービスは、当社医薬品等に関する一般的なお問い合わせに対して回答するものとし、次の各号に掲げるお問い合わせについては、回答しないものとします。
- 当社医薬品等と関係のないお問い合わせ、または本サービスの回答範囲を逸脱したお問い合わせ
- 具体的な症状や治療方法に関するお問合せ
- 当社に適用される法令、ガイドラインまたは行政上の指導、当社自主規制その他当社が遵守すべきルールにより回答できないお問い合わせ
- 文字化け等により入力内容が判断できないお問い合わせ
- 前各号に掲げるほか、本サービスにより、適切な回答をすることができないと当社が判断した事項に関するお問い合わせ
- 本サービスは、日本語のみに対応しています。
- 本サービスは、当社医薬品の副作用、不具合及び有害事象の報告を受け付けていません。
- お問い合わせの内容によっては、本サービスでは十分に回答できない場合もございます。予めご了承下さい。
- 本サービスの利用可能時間は、以下のとおりです。
- AIチャット
24時間365日 - 有人チャット
平日9:00~17:00
- AIチャット
- 前項に関わらず、メンテナンス及び障害等のため一時的に本サービスを中断する場合がございます。
本サービスのご利用の際には、原則として、個人情報(お名前、ご住所、電話番号、メールアドレス等)を入力しないようお願いします。ただし、AIチャット及び有人チャットを問わず、当社医薬品の適用外使用に関するお問い合わせについては、コンプライアンス上の理由により、当社より、氏名及び施設名の入力を求める場合がございます。この場合には、当社プライバシーポリシーの内容を確認いただき、同意いただける場合に限り、入力して下さい(プライバシーポリシーについては「VIII 利用規約、プライバシーポリシー」に記載のURLからアクセス下さい)。その他の場合に、当社より個人情報の入力を求めることは一切ございません。
- 当社医薬品のご使用にあたっては、最新の添付文書等をご確認下さい。
- 当社は、本サービスまたは本サービスにより提供される情報の利用に際し生じた結果については、一切責任を負いません。
本サービスの利用にあたり、以下の各号の行為を禁止します。
- 本サービスにより提供される情報を複製、複写、転載、改変等する行為
- 第三者または当社の知的財産権その他の権利を侵害する行為
- 第三者または当社を誹謗中傷し、または名誉・信用を毀損する行為
- 本サービスの利用による営利目的の行為
- 本サービスの運営又は他の利用者による本サービスの利用の妨げとなる行為
- 前各号のほか、当社が不適当であると判断する行為
当社は、いつでも本サービスの提供を終了、またはその内容を変更することができるものとします。
本サービスの利用に関しては、以下の利用規約及びプライバシーポリシーが併せて適用されますので、ご確認下さい。


