
Effisayil™ 1試験の臨床成績とGPPの新たな重症度評価指標
サイトへ公開:2024年01月30日 (火)
クイックリンク

ご監修:
加藤 則人 先生
京都府立医科大学大学院 医学研究科 地域医療・社会医学分野 医療フロンティア展開学 教授
はじめに
膿疱性乾癬(Generalized Pustular Psoriasis[GPP])は膿疱が広範囲に発生し、しばしば全身性の炎症を伴うことを特徴とする稀な自己炎症性皮膚疾患です1)。GPPの希少性により、これまで、重症度を評価するためのGPPに特化した標準的指標はなく、日常診療での治療や新規治療薬における有効性のモニタリングにおいて課題となっていました。日常診療や臨床試験において疾患の重症度を正確に評価できる標準的指標が一貫して適用されることは、効果的な患者ケアの提供、新規治療法の開発評価に必要不可欠です2)。一方で、重症度評価指標の心理測定学的な特性の評価は症例数の少なさによる統計的な検出力不足のために評価が困難とされてきました。GPPGA*1、GPPASI*2はGPPの重症度評価、治療効果のモニタリングのために、それぞれPGAとPASIをベースに作成されたスコアであり、スペビゴ®の有効性・安全性を検討したEffisayilTM 1試験の評価指標として使用されましたが、評価指標として妥当性の評価が必要とされています。
ここでは、EffisayilTM 1試験で示された臨床成績を概括するとともに、EffisayilTM 1試験のデータを用いてGPPの臨床報告アウトカム(clinRO)としてのGPPGA合計スコア、GPPGA膿疱サブスコア、GPPASIの妥当性評価のために行われた心理測定学的観点からの評価(psychometric validation)の結果1)を紹介します。
*1 GPPGA:膿疱性乾癬に対する医師による全般的評価(Generalized Pustular Psoriasis Physician Global Assessment)
*2 GPPASI:汎発性膿疱性乾癬面積重症度指数。乾癬の重症度と面積の指標として確立されているPASI(Psoriasis Area and Severity Index)をGPP用に適合させたもの。病変の状態を0~72でスコア化している。GPPASI 75は、GPPASIスコアがベースラインから75%以上改善したことを表す。
EffisayilTM 1試験で示された臨床成績の概括
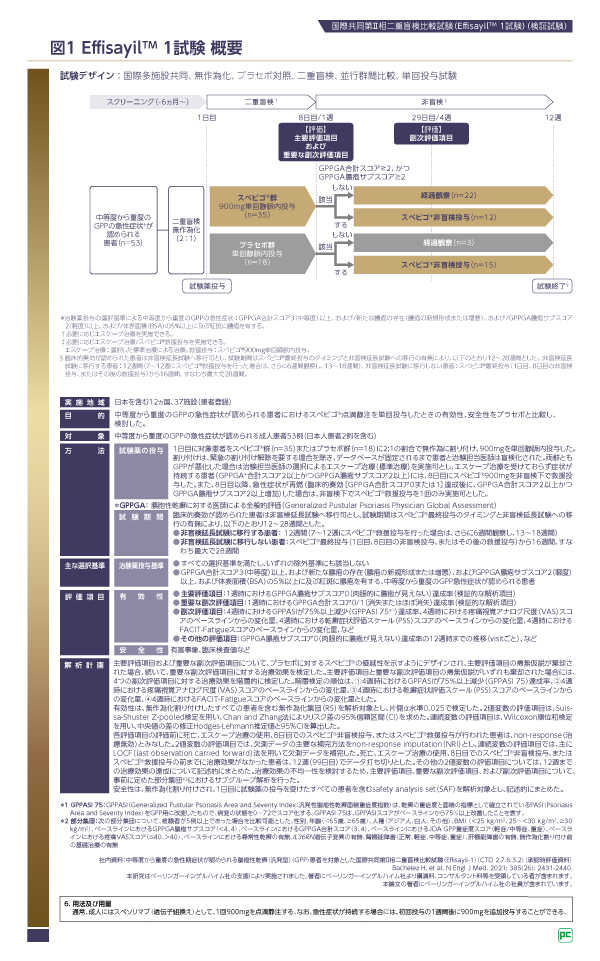
1)試験デザイン
スペビゴ®の有効性が検証されたEffisayilTM 1試験は、急性症状を有するGPP患者を対象に行われた初めての二重盲検無作為化比較試験です3)4)。対象は日本人患者2例を含む中等度から重度の急性症状*3が認められるGPP患者53例で、スペビゴ®群とプラセボ群が2:1の割合で割り付けられ(図1)、900 mgを単回静脈内投与しました。両群ともGPPが悪化した場合は治験担当医師の選択によるエスケープ治療(標準治療)を実施可とし、エスケープ治療を受けておらず症状が持続する患者(GPPGA合計スコア2以上かつGPPGA膿疱サブスコア2以上)には、8日目にスペビゴ® 900 mgを非盲検下で救援投与しました。また、8日目以降、急性症状が再燃(臨床的奏効[GPPGA合計スコア0または1]達成後に、GPPGA合計スコア2以上かつGPPGA膿疱サブスコア2以上増加)した場合は、非盲検下でスペビゴ®救援投与を1回のみ実施可としました。
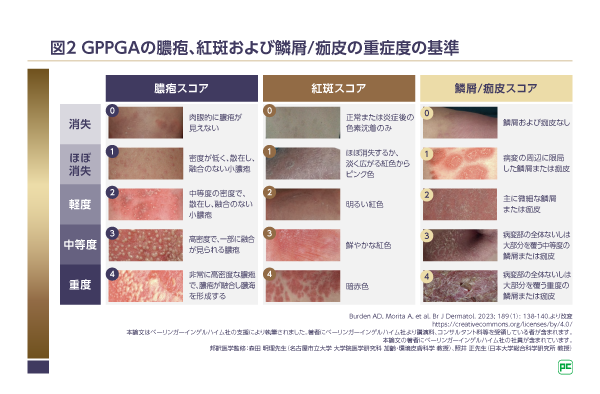
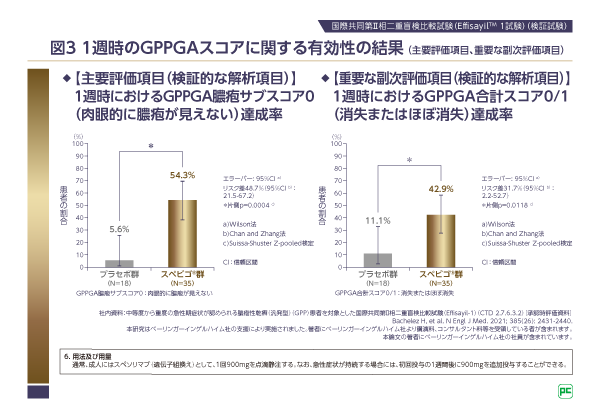
主要評価項目(検証的な解析項目)は「1週時におけるGPPGA膿疱サブスコア0(肉眼的に膿疱が見えない)達成率」、重要な副次評価項目(検証的な解析項目)は「1週時におけるGPPGA合計スコア0/1(消失またはほぼ消失)達成率」です。なお、EffisayilTM 1試験を含むすべてのスペビゴ®の臨床試験で、GPPに特化した重症度評価指標として新たに作成されたGPPGA/GPPASIが用いられています(図2)。
*3 EffisayilTM 1試験における中等度から重度のGPP急性症状の定義:
・ GPPGA合計スコア3(中等度)以上、および /・ 新たな膿疱の存在(膿疱の新規形成または増悪)、および /・ GPPGA膿疱サブスコア2(軽度)以上、および /・ 体表面積(BSA)の5%以上に及ぶ紅斑に膿疱を有する
2)EffisayilTM 1試験の臨床成績
主要評価項目(1週時のGPPGA膿疱サブスコア0達成率:スペビゴ®群54.3%[19/35例]、プラセボ群5.6%[1/18例])、重要な副次評価項目(1週時のGPPGA合計スコア0/1達成率:スペビゴ®群42.9%[15/35例]、プラセボ群11.1%[2/18例])の検証結果から、スペビゴ®群において1週時における膿疱および皮膚症状の有意な改善が認められました(それぞれ片側p=0.0004、片側p=0.0118、いずれもSuissa-Shuster Z-pooled検定、検証的な解析項目。図3)。
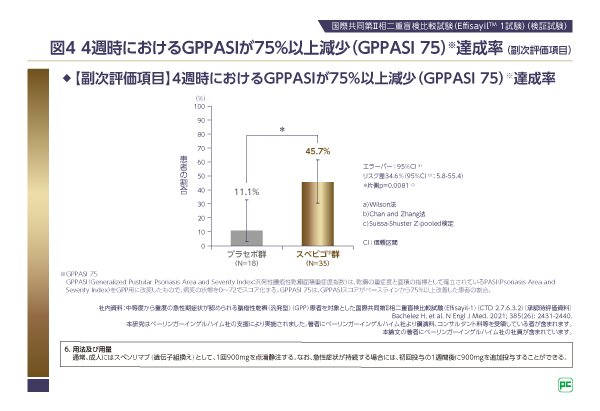
副次評価項目である4週時のGPPASI 75達成率についても、スペビゴ®群45.7%(16/35例)、プラセボ群11.1%(2/18例)で、有意差が認められました(片側p=0.0081、Suissa-Shuster Z-pooled検定。図4)。
副次評価項目のうち、患者報告アウトカムである4週時における疼痛VASスコアのベースラインからの絶対変化量、PSSスコアのベースラインからの絶対変化量(中央値)、FACIT-Fatigueスコアのベースラインからの絶対変化量においても、スペビゴ®群はプラセボ群と比較して有意差が認められました(表1)。
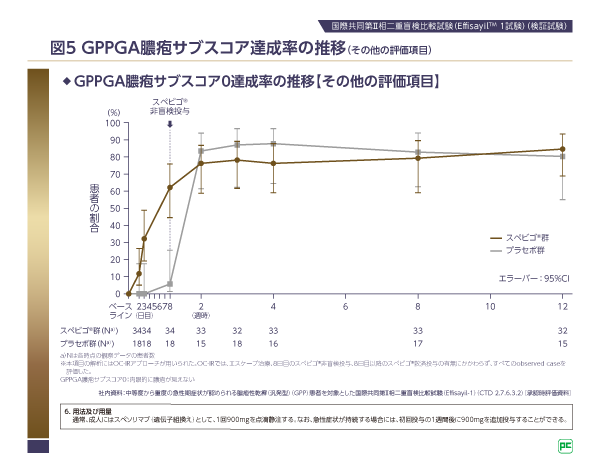
無作為化割り付けしたすべての患者において、エスケープ治療、8日目のスペビゴ®非盲検投与、その後のスペビゴ®救援投与の有無にかかわらず、観察された症例に基づきGPPGA膿疱サブスコア0達成率の推移を検討した結果、スペビゴ®群のGPPGA膿疱サブスコア0達成率は、8日目で61.8%、12週時で84.4%でした(図5)。なお、スペビゴ®群の34.3%(12例)、プラセボ群の83.3%(15例)の患者が8日目のスペビゴ®非盲検投与を受けていました。

3)EffisayilTM 1試験の安全性
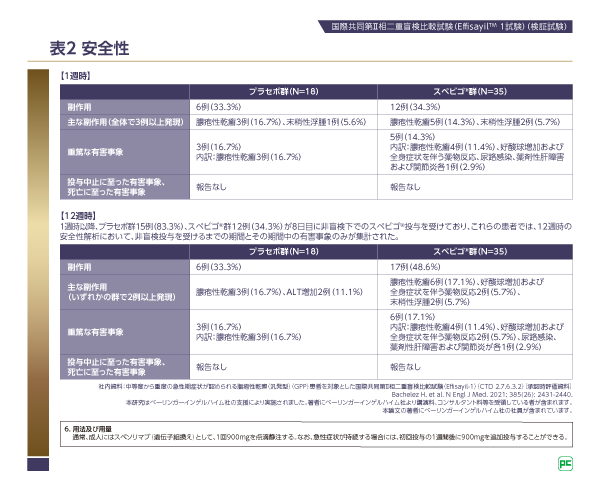
EffisayilTM 1試験では、1週時と12週時に安全性の評価を行っています。
1週時までに、スペビゴ®群12例(34.3%)、プラセボ群6例(33.3%)に副作用が発現しました。主な副作用は、スペビゴ®群では膿疱性乾癬5例(14.3%)、末梢性浮腫2例(5.7%)、プラセボ群では膿疱性乾癬3例(16.7%)、末梢性浮腫1例(5.6%)でした。
1週時までに発現した重篤な有害事象はスペビゴ®群で5例(14.3%)、プラセボ群で3例(16.7%)に発現しました。内訳は、スペビゴ®群が膿疱性乾癬4例(11.4%)、好酸球増加および全身症状を伴う薬物反応、尿路感染、薬剤性肝障害および関節炎が各1例(2.9%)、プラセボ群が膿疱性乾癬3例(16.7%)でした。
投与中止に至った有害事象、死亡に至った有害事象は報告されませんでした(表2)。
GPPGA、GPPASIの心理測定学的観点からの評価(psychometric validation)
現在のところ、GPPの重症度を評価するためのGPPに特異的かつ標準化された評価指標はありません。EffisayilTM 1試験に使用されたGPPGA/GPPASIが今後GPPの標準化された評価指標になりうるのか、評価の再現性や測定すべき内容をどの程度測定できているかを確認する目的で、心理測定学的観点からの評価が行われました。
GPPGA、GPPASIの信頼性と妥当性を検討する方法として、EffisayilTM 1試験における1週時のデータから、表3に示す評価法などが実施されました。妥当性の評価にはJDA-GPPSI*4、CGI-I*5、DLQI*6、EQ-5D-5L*7が用いられました。
評価指標として再現性があるかの評価ではスコアの一致度は許容範囲内と確認され、GPPGA合計スコア、GPPGA膿疱サブスコア、GPPASIには再現性があり、信頼性のある評価指標であることが示されました。また、GPPGA合計スコア、GPPGA膿疱サブスコアはCGI-I、DLQI(合計/item 1/item 2)、EQ-5D(痛み/不快感)、EQ-VASなどの皮膚科医が現在使用している指標との間に相関があることが確認されました。さらに、これらの評価指標は重症度が高いと考えられる患者において有意に高いスコアが得られることが確認され、GPPGA合計スコア、GPPGA膿疱サブスコア、GPPASIは重症度を識別するための精度にも問題がないことが確認されました。
このことから、GPPの臨床報告アウトカムとしてのGPPGA合計スコア、GPPGA膿疱サブスコア、GPPASIの信頼性、妥当性が示され、今後臨床における標準的指標としての使用が期待できる結果となりました。同時に、EffisayilTM 1試験の主要評価項目(1週時のGPPGA膿疱サブスコア0達成率)、重要な副次評価項目(1週時のGPPGA合計スコア0/1達成率)の設定が妥当であったと示される結果となりました。
*4 JDA-GPPSI:Japanese Dermatological Association Generalized Pustular Psoriasis Severity Index
*5 CGI-I:Clinical Global Impression-Improvement
*6 DLQI:Dermatology Life Quality Index
*7 EQ-5D-5L:EuroQol 5-dimensions 5-levels

おわりに
心理測定学的な評価の結果は、GPPGAとGPPASIを現在進行中および将来のGPPの臨床試験で使用する上での妥当性を支持するものであり、有効性の評価をGPPGA/GPPASIを用いて行ったEffisayilTM 1試験の妥当性が示される結果となりました。EffisayilTM 1試験ではスペビゴ投与により1週時点で54.3%の患者においてGPPGA膿疱サブスコア0(膿疱の消失)が認められています。
また、GPPGAやGPPASIは臨床においてより良い患者ケアを行うための有用な評価指標となる可能性があります。GPPGAやGPPASIが臨床試験や日常診療において使用されていくことで、新しいGPP治療法の比較が可能になり、より良いケアや新規治療法の開発が進んでいくことが期待できます。GPPGAとGPPASIは、広く使用されているPGAとPASIをベースにしており、皮膚科医の先生方に使いやすい評価指標となっておりますので、是非日常診療にご活用いただければと思います。
References
- Burden AD, et al. J Eur Acad Dermatol Venereol. 2023; 37(7): 1327-1335.
本研究はベーリンガーインゲルハイム社の支援により実施されました。著者にベーリンガーインゲルハイム社より講演料、コンサルタント料等を受領している者が含まれます。本論文の著者にベーリンガーインゲルハイム社の社員が含まれています。 - Burden AD, et al. Am J Clin Dermatol. 2022; 23(Suppl 1): 39-50.
著者にベーリンガーインゲルハイム社より講演料、コンサルタント料等を受領している者が含まれます。 - 社内資料:中等度から重度の急性期症状が認められる膿疱性乾癬(汎発型)(GPP)患者を対象とした国際共同第Ⅱ相二重盲検比較試験(Effisayil-1試験)(CTD 2.7.6.3.2)[承認時評価資料]
- Bachelez H, et al. N Engl J Med. 2021; 385(26): 2431-2440.
本研究はベーリンガーインゲルハイム社の支援により実施されました。著者にベーリンガーインゲルハイム社より講演料、コンサルタント料等を受領している者が含まれます。本論文の著者にベーリンガーインゲルハイム社の社員が含まれています。 - Aaronson N, et al. Qual Life Res. 2002; 11(3): 193-205.
日本ベーリンガーインゲルハイム
メディカルチャット 利用規約
当社の「日本ベーリンガーインゲルハイム メディカルチャット」(以下「本サービス」といいます)のご利用に際しては、本利用規約が適用されますので、必ず以下の記載事項をご確認下さい。
利用規約
- 本サービスは、当社所定のウェブページから文字によりお問い合わせいただくことにより、当社医薬品等に関する一般的な情報を、人工知能あるいは当社担当者により、文字及び図表により回答するサービスです(以下、人工知能による回答サービスを「AIチャット」、当社担当者による回答サービスを「有人チャット」といいます。)。ただし、AIチャットによる回答を原則とし、有人チャットは、AIチャットでの回答に対し、有人チャットでの回答も希望された場合に、提供させていただきます。
- 本サービスをご利用いただくことができるのは、当社医薬品等を扱いかつ国内に在住する医療関係者の方に限られます。当該医療関係者以外の方は、ご利用いただくことができません。
- 本利用規約に同意いただけない場合、本サービスを利用いただくことができません。本利用規約を最後までお読みいただき、「同意して利用する」ボタンを押した上で、本サービスをご利用下さい。
- 本サービスは、当社医薬品等に関する一般的なお問い合わせに対して回答するものとし、次の各号に掲げるお問い合わせについては、回答しないものとします。
- 当社医薬品等と関係のないお問い合わせ、または本サービスの回答範囲を逸脱したお問い合わせ
- 具体的な症状や治療方法に関するお問合せ
- 当社に適用される法令、ガイドラインまたは行政上の指導、当社自主規制その他当社が遵守すべきルールにより回答できないお問い合わせ
- 文字化け等により入力内容が判断できないお問い合わせ
- 前各号に掲げるほか、本サービスにより、適切な回答をすることができないと当社が判断した事項に関するお問い合わせ
- 本サービスは、日本語のみに対応しています。
- 本サービスは、当社医薬品の副作用、不具合及び有害事象の報告を受け付けていません。
- お問い合わせの内容によっては、本サービスでは十分に回答できない場合もございます。予めご了承下さい。
- 本サービスの利用可能時間は、以下のとおりです。
- AIチャット
24時間365日 - 有人チャット
平日9:00~17:00
- AIチャット
- 前項に関わらず、メンテナンス及び障害等のため一時的に本サービスを中断する場合がございます。
本サービスのご利用の際には、原則として、個人情報(お名前、ご住所、電話番号、メールアドレス等)を入力しないようお願いします。ただし、AIチャット及び有人チャットを問わず、当社医薬品の適用外使用に関するお問い合わせについては、コンプライアンス上の理由により、当社より、氏名及び施設名の入力を求める場合がございます。この場合には、当社プライバシーポリシーの内容を確認いただき、同意いただける場合に限り、入力して下さい(プライバシーポリシーについては「VIII 利用規約、プライバシーポリシー」に記載のURLからアクセス下さい)。その他の場合に、当社より個人情報の入力を求めることは一切ございません。
- 当社医薬品のご使用にあたっては、最新の添付文書等をご確認下さい。
- 当社は、本サービスまたは本サービスにより提供される情報の利用に際し生じた結果については、一切責任を負いません。
本サービスの利用にあたり、以下の各号の行為を禁止します。
- 本サービスにより提供される情報を複製、複写、転載、改変等する行為
- 第三者または当社の知的財産権その他の権利を侵害する行為
- 第三者または当社を誹謗中傷し、または名誉・信用を毀損する行為
- 本サービスの利用による営利目的の行為
- 本サービスの運営又は他の利用者による本サービスの利用の妨げとなる行為
- 前各号のほか、当社が不適当であると判断する行為
当社は、いつでも本サービスの提供を終了、またはその内容を変更することができるものとします。
本サービスの利用に関しては、以下の利用規約及びプライバシーポリシーが併せて適用されますので、ご確認下さい。


