
オフェブの副作用
サイトへ公開:2020年05月05日 (火)
クイックリンク
オフェブの副作用および副作用マネジメントについて解説します。副作用情報については、適正使用ガイドによりご確認いただくようお願いいたします。
オフェブの副作用
1,061例を対象としたINPULSIS試験で、オフェブ150mg 1日2回を投与された638例における主な副作用は、下痢342例(53.6%)、悪心122例(19.1%)、肝酵素上昇67例(10.5%)および腹痛65例(10.2%)でした。オフェブが投与された日本人症例76例における主な副作用は、下痢51例(67.1%)、肝酵素上昇21例(27.6%)、食欲減退11例(14.5%)、悪心9例(11.8%)でした。
オフェブの主な副作用は「胃腸障害」で、下痢、悪心・嘔吐などの消化器症状が発現することがあります。また、肝酵素(AST、ALT、ALP、γ-GTP等)およびビリルビンが上昇することがあります。
オフェブはVEGFR阻害作用を持つチロシンキナーゼ阻害剤です。VEGFR阻害剤には特徴的な副作用が報告されています。VEGFR阻害剤共通の副作用として、血栓塞栓症、消化管穿孔、出血、創傷治癒遅延、顎骨壊死が発現する可能性があります。また、VEGFR阻害作用を有する一部の薬剤では、癌患者を対象とした臨床試験において、重篤な皮膚障害が報告されています。
国内製造販売後においては、オフェブとの因果関係が否定できない血小板減少が報告されています。
IPF患者を対象としたINPULSIS試験では報告されていませんが、癌患者を対象とした本剤の臨床試験において、間質性肺炎の発現が認められています。
AST:aspartate aminotransferase(アスパラギン酸アミノトランスフェラーゼ)、ALT:alanine aminotransferase(アラニンアミノトランスフェラーゼ)、ALP:alkaline phosphatase(アルカリホスファターゼ)、γ-GTP:gamma glutamyl transferase(ガンマグルタミルトランスフェラーゼ)
オフェブ投与開始前の注意事項
肝機能障害のある患者
- 本剤の投与開始前に必ず肝機能検査(AST、ALT、ビリルビン等)を行い、肝機能障害の有無を確認してください。
中等度および高度の肝機能障害(Child-Pugh B、C)のある患者には治療上やむを得ないと判断される場合を除き、本剤の使用は避けてください。
投与された場合は、血中濃度が過度に上昇し、重篤な副作用が発現する可能性があります。
肝障害(Child-Pugh A、B)を有する被験者を対象とした海外第Ⅰ相試験において、本剤100mgを単回投与した結果、健康被験者と比較して軽度肝障害(Child-Pugh A)のある被験者ではCmaxおよびAUCが2.2倍、中等度肝障害(Child-Pugh B)のある被験者ではCmaxが7.6倍、AUCが8.7倍となり、特に中等度肝障害のある場合にニンテダニブの曝露量が上昇することが示されました。
このため、高度(Child-Pugh C)の肝機能障害のある患者でもニンテダニブの曝露量が上昇する可能性があります。
また、中等度(Child-Pugh B)および高度(Child-Pugh C)の肝機能障害のある患者では本剤の有効性および安全性は検討されていません。
治療上やむを得ないと判断される場合を除き、本剤の使用は避けてください。
表1 Child-Pugh分類(参考)
| スコア | 1 | 2 | 3 |
|---|---|---|---|
| 脳症 | ない | 軽度 | ときどき昏睡 |
| 腹水 | ない | 少量 | 中等量 |
| 血清ビリルビン(mg/dL) | <2 | 2.0〜3.0 | >3.0 |
| 血清アルブミン(g/dL) | >3.5 | 2.8〜3.5 | <2.8 |
| プロトロンビン活性値(%) | >70 | 40〜70 | <40 |
| 総スコア | クラス | 重症度 |
|---|---|---|
| 5〜6 | A | 軽度 |
| 7〜9 | B | 中等度 |
| 10〜15 | C | 高度 |
Pugh RN. et al.: Br J Surg 1973; 60(8): 646-649 より改変
主な副作用
肝機能障害
AST、ALT、ビリルビン等の上昇を伴う肝機能障害があらわれることがあります。
- 本剤の投与開始前および投与中は必ず定期的に肝機能検査(AST、ALT、ビリルビン等)を行ってください。
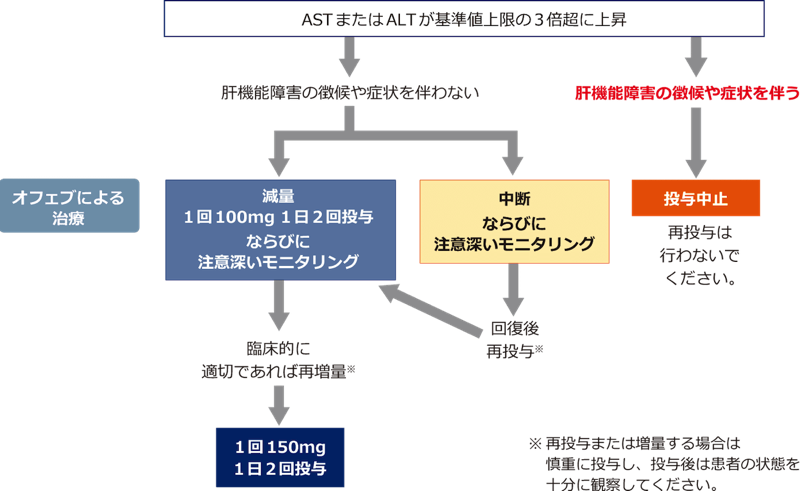
- ASTまたはALTに基準値上限の3倍を超える上昇が認められた場合は、「対処法」を参考に、本剤の減量・中断または投与を中止してください。
- 「倦怠感」、「発熱」、「黄疸」、「悪心・嘔吐」、「発疹」、「かゆみ」などの症状があらわれた場合は、医療機関を受診するよう患者に指導してください。
INPULSIS試験では、AST、ALTおよびビリルビンが基準値上限の1.5倍を超える患者は除外されていました。
■肝機能の検査
INPULSIS試験では、本剤の投与開始から6週までは2週毎、6~36週までは6週毎、36~52週までは8週毎に肝機能検査を実施しました。
本剤の投与前
- 本剤の投与開始前に、必ず肝機能検査(AST、ALT、ビリルビン等)を行ってください。肝機能障害の程度を評価の上、本剤の投与の可否を判断してください。
本剤の投与中
- 定期的な肝機能検査(AST、ALT、ビリルビン等)を実施し、注意深く観察してください。
- 来院時または臨床上の必要性に応じて検査を行ってください。
肝機能障害のある患者に投与する場合
- 肝機能検査をより頻回に行うなど、肝機能障害の程度にかかわらず慎重に患者の状態を観察してください。
■ASTおよびALT上昇に対する対処法
本剤の投与に伴い、AST、ALTが基準値上限の3倍を超えた場合は、本剤を減量または中断し、患者の状態を十分に観察してください。黄疸などの肝機能障害の徴候や症状が認められた場合には、本剤の投与を中止し、再投与は行わないでください。
【ASTおよびALT上昇に対する対処法】
下痢
下痢は、INPULSIS試験のオフェブ群において、最も頻度の高い副作用でした。
- 下痢に伴い、脱水、電解質失調、腎機能障害などの重篤な臨床経過をたどる場合があります。
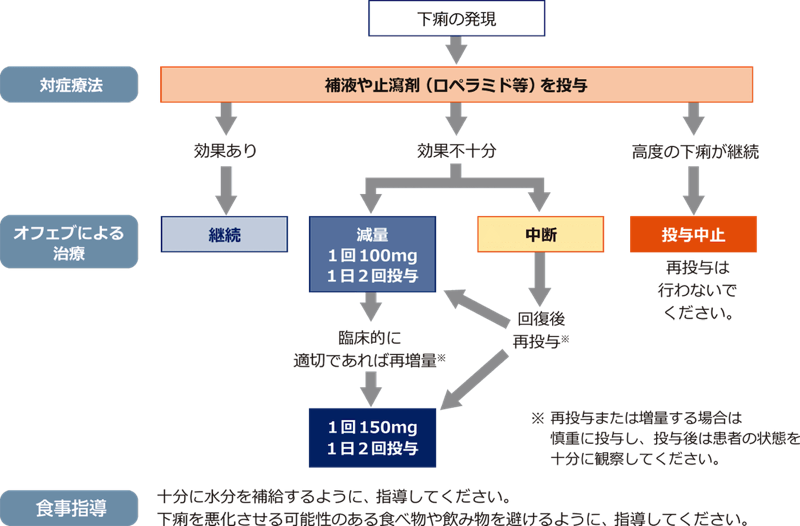
- 「対処法」を参考に、水分補給・電解質投与や止瀉剤の投与など、適切な処置を速やかに行うとともに、本剤の減量・中断または投与中止を考慮してください。対症療法の施行後も、重度の下痢が継続する場合には、本剤の投与を中止し、再投与は行わないでください。
本剤の投与に伴う下痢は、対症療法や本剤の減量・中断で、多くの場合は管理可能ですが、一部の患者では投与中止に至ることがあります[INPULSIS試験:4.4%(28例/638例)]。
■対処法
本剤の投与に伴う下痢は、通常、初回発現時にできるだけ速やかにロペラミドなどの止瀉剤による対症療法を行います。適切な対症療法の施行にもかかわらず、下痢が継続する場合には、本剤の減量・中断または投与中止を考慮してください。対症療法にもかかわらず持続するような高度(重度)の下痢の場合は、本剤による治療を中止し、再投与は行わないでください。
【下痢に対する対処法】
悪心・嘔吐
- 悪心・嘔吐が発現した場合は、悪心・嘔吐に対する標準的な対症療法を行ってください。
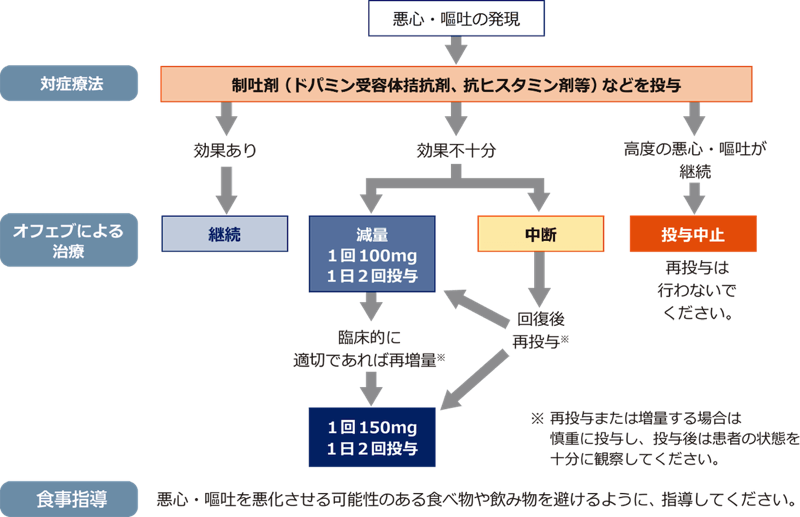
- 制吐剤の投与などの適切な対症療法を行っても症状が持続する場合は、本剤の減量・中断または投与中止を考慮してください(「対処法」参照)。
有害事象として発現した悪心・嘔吐の多くは軽度から中等度でしたが、一部の患者では投与中止に至ることがあります[INPULSIS試験:悪心2.0%(13例/638例)、嘔吐0.8%(5例/638例)]。
■対処法
悪心・嘔吐に対する、標準的な対症療法を行ってください。適切な対症療法の施行にもかかわらず、悪心・嘔吐が継続する場合には、本剤の減量または中断を検討してください。高度の症状が継続する場合は、本剤の投与を中止してください。
【悪心・嘔吐に対する対処法】
注意すべき副作用
血栓塞栓症
血栓塞栓事象があらわれることがあります。
- 必ず血栓および心血管系リスクをご確認いただき、リスクの高い患者には、投与の可否を慎重に検討してください。
- 本剤を使用する際は慎重に投与し、投与中は観察を十分に行ってください。
- 血栓塞栓症の徴候がみられる場合は本剤による治療の中断を検討してください。
■対処法
血栓塞栓症の徴候がみられる場合は本剤による治療の中断を検討してください。
血小板減少
血小板減少があらわれることがあります。
- 出血に至った重篤な症例も報告されているため、定期的に血液検査を行うなど観察を十分に行ってください。
■対処法
異常が認められた場合は、本剤の投与を中止するなど、適切な処置を行ってください。
消化管穿孔
消化管穿孔があらわれることがあります。
- 腹部の外科的処置の既往がある患者には十分に注意してください。
- 胃腸出血/潰瘍の既往がある患者には十分に注意してください。
■対処法
本剤投与中は観察を十分に行い、異常が認められた場合には、内視鏡、腹部X線、CT等の必要な検査を行い、本剤の投与を中止するなど、適切な処置を行ってください。
消化管穿孔が認められた患者には、再投与しないでください。
創傷治癒遅延
創傷治癒を遅らせる可能性があります。
- 手術時は本剤の投与を中断してください。
- 手術後に本剤による治療を開始するとき、または中断後に再開するときは、創傷治癒の適切な診断に基づき判断してください。再開後は患者の状態を十分に観察してください。
■対処法
異常が認められた場合は、本剤の投与を中断し、適切な処置を行ってください。
出血
出血リスクを助長する可能性があります。
- 「出血性素因がある」、「抗凝固剤治療を行っている」などの出血リスクを必ずご確認いただき、投与の可否を慎重に検討してください。
- 出血が認められた場合は、本剤の投与を中止するなど、適切な処置を行ってください。
- 胃腸出血/潰瘍の既往がある患者には十分に注意してください。
■対処法
出血が認められた場合は、本剤の投与を中止するなど、適切な処置を行ってください。
間質性肺炎
- 本剤の癌を対象とした臨床試験で、間質性肺炎が認められています。
- 本剤の使用中にみられるIPFの悪化や進行と、薬剤性間質性肺疾患を判別することは困難であることから、本剤の投与中は患者の状態を注意深く観察してください。
- 「息切れ、空咳の増強」、「発熱」などの症状があらわれた場合は、医療機関を受診するよう患者に指導してください。
■対処法
胸部画像検査や呼吸機能検査で急激な悪化等の薬剤性間質性肺炎の徴候がみられる場合は、本剤の投与を中止し、ステロイド治療等の適切な処置を行ってください。
顎骨壊死
- VEGFR阻害剤において、顎骨やその他の骨壊死との関連性が報告されています。
- 本剤はVEGFR阻害剤であることから、投与中は患者の状態に十分注意してください。
■対処法
異常がみられた場合は、本剤の投与を中断し、適切な処置を行ってください。
重篤な皮膚障害
- VEGFR阻害作用を有する一部の薬剤では、癌患者を対象とした臨床試験において重篤な皮膚および皮下組織障害の発現が認められています。
- 本剤はVEGFR阻害剤であることから、投与中は患者の状態に十分注意してください。
■対処法
異常がみられた場合は、本剤の投与を中断し、適切な処置を行ってください。
その他の関連情報


オフェブの患者さんサポート資材一覧
日本ベーリンガーインゲルハイム
メディカルチャット 利用規約
当社の「日本ベーリンガーインゲルハイム メディカルチャット」(以下「本サービス」といいます)のご利用に際しては、本利用規約が適用されますので、必ず以下の記載事項をご確認下さい。
利用規約
- 本サービスは、当社所定のウェブページから文字によりお問い合わせいただくことにより、当社医薬品等に関する一般的な情報を、人工知能あるいは当社担当者により、文字及び図表により回答するサービスです(以下、人工知能による回答サービスを「AIチャット」、当社担当者による回答サービスを「有人チャット」といいます。)。ただし、AIチャットによる回答を原則とし、有人チャットは、AIチャットでの回答に対し、有人チャットでの回答も希望された場合に、提供させていただきます。
- 本サービスをご利用いただくことができるのは、当社医薬品等を扱いかつ国内に在住する医療関係者の方に限られます。当該医療関係者以外の方は、ご利用いただくことができません。
- 本利用規約に同意いただけない場合、本サービスを利用いただくことができません。本利用規約を最後までお読みいただき、「同意して利用する」ボタンを押した上で、本サービスをご利用下さい。
- 本サービスは、当社医薬品等に関する一般的なお問い合わせに対して回答するものとし、次の各号に掲げるお問い合わせについては、回答しないものとします。
- 当社医薬品等と関係のないお問い合わせ、または本サービスの回答範囲を逸脱したお問い合わせ
- 具体的な症状や治療方法に関するお問合せ
- 当社に適用される法令、ガイドラインまたは行政上の指導、当社自主規制その他当社が遵守すべきルールにより回答できないお問い合わせ
- 文字化け等により入力内容が判断できないお問い合わせ
- 前各号に掲げるほか、本サービスにより、適切な回答をすることができないと当社が判断した事項に関するお問い合わせ
- 本サービスは、日本語のみに対応しています。
- 本サービスは、当社医薬品の副作用、不具合及び有害事象の報告を受け付けていません。
- お問い合わせの内容によっては、本サービスでは十分に回答できない場合もございます。予めご了承下さい。
- 本サービスの利用可能時間は、以下のとおりです。
- AIチャット
24時間365日 - 有人チャット
平日9:00~17:00
- AIチャット
- 前項に関わらず、メンテナンス及び障害等のため一時的に本サービスを中断する場合がございます。
本サービスのご利用の際には、原則として、個人情報(お名前、ご住所、電話番号、メールアドレス等)を入力しないようお願いします。ただし、AIチャット及び有人チャットを問わず、当社医薬品の適用外使用に関するお問い合わせについては、コンプライアンス上の理由により、当社より、氏名及び施設名の入力を求める場合がございます。この場合には、当社プライバシーポリシーの内容を確認いただき、同意いただける場合に限り、入力して下さい(プライバシーポリシーについては「VIII 利用規約、プライバシーポリシー」に記載のURLからアクセス下さい)。その他の場合に、当社より個人情報の入力を求めることは一切ございません。
- 当社医薬品のご使用にあたっては、最新の添付文書等をご確認下さい。
- 当社は、本サービスまたは本サービスにより提供される情報の利用に際し生じた結果については、一切責任を負いません。
本サービスの利用にあたり、以下の各号の行為を禁止します。
- 本サービスにより提供される情報を複製、複写、転載、改変等する行為
- 第三者または当社の知的財産権その他の権利を侵害する行為
- 第三者または当社を誹謗中傷し、または名誉・信用を毀損する行為
- 本サービスの利用による営利目的の行為
- 本サービスの運営又は他の利用者による本サービスの利用の妨げとなる行為
- 前各号のほか、当社が不適当であると判断する行為
当社は、いつでも本サービスの提供を終了、またはその内容を変更することができるものとします。
本サービスの利用に関しては、以下の利用規約及びプライバシーポリシーが併せて適用されますので、ご確認下さい。



