
高齢者糖尿病の合併症の実際とジャディアンスのエビデンス
サイトへ公開:2023年11月29日 (水)
クイックリンク
日常診療において、糖尿病治療では、どのようなことを重視されますか?

こちらのような71歳、HbA1c 7.6%、ADL自立、認知機能正常で、糖尿病の薬物療法を行っていない患者さんに対して、先生方はどのような点を重視して、糖尿病治療を行っていらっしゃいますか。
コンテンツサマリー

高齢者糖尿病の合併症の実際
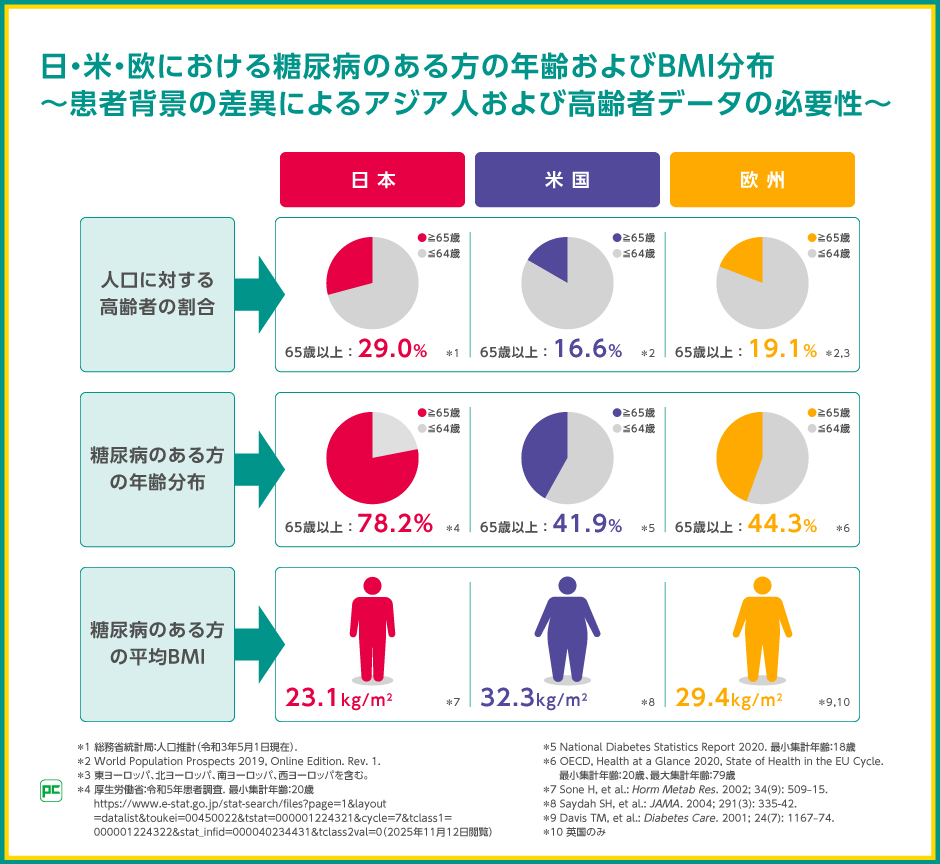
高齢社会となった日本では、糖尿病のある方においても高齢者の割合が欧米よりも高いことが報告されており、厚生労働省による患者調査では、糖尿病のある方の77.2%が65歳以上であると報告されました。
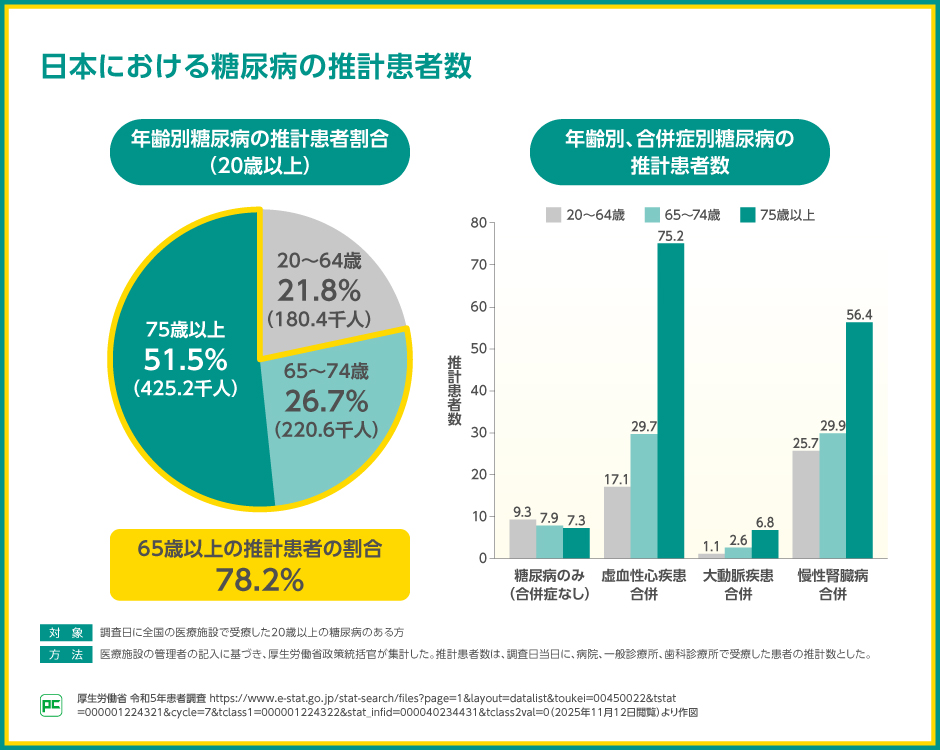
患者調査では、糖尿病のある方は高齢の方が多いことだけでなく、年齢が上がるほど、虚血性心疾患や慢性腎臓病を合併する患者さんの数が増えることが示されました。
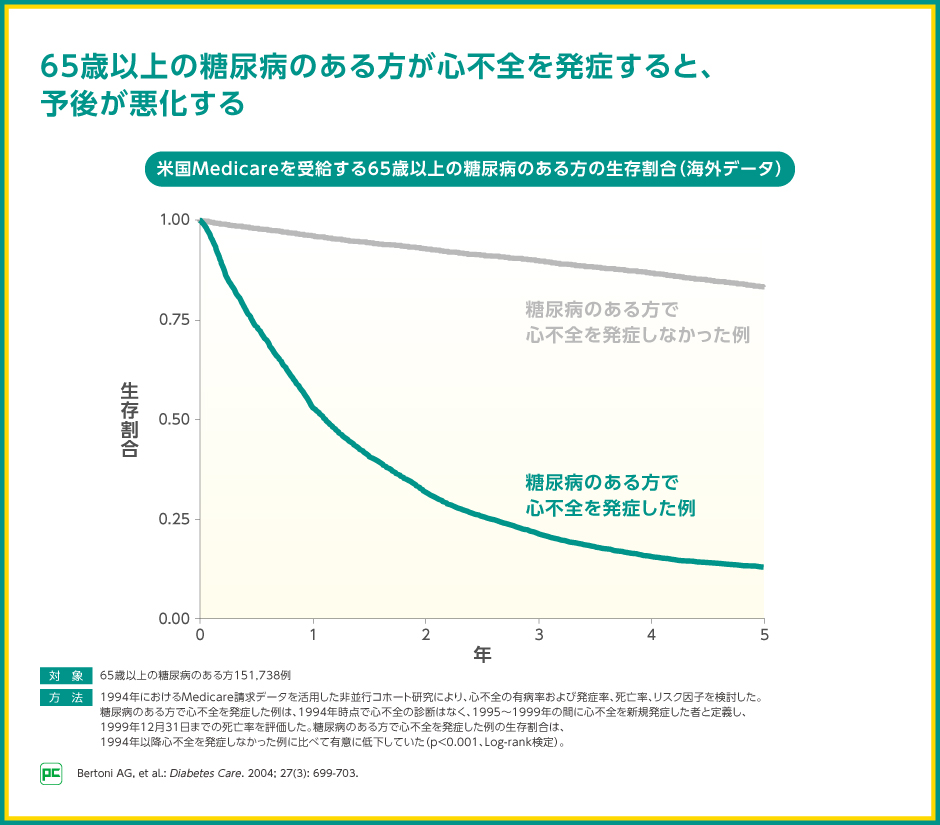
65歳以上の糖尿病のある方では、心不全を合併すると予後が悪化するという報告もあることから、高齢者糖尿病においては、心不全等の合併症への影響も考慮した治療介入が重要です。
ジャディアンスのエビデンス① 日本人高齢者2型糖尿病を対象としたEMPA-ELDERLY試験

ジャディアンスでは、合併症や年齢等、様々な2型糖尿病のある方を対象としたエビデンスが複数報告されています。
EMPA-ELDERLY試験は、高齢者糖尿病に対するSGLT2阻害薬の影響を検討するため、国内18施設において、65歳以上の高齢者2型糖尿病129例を対象として行われた、プラセボ対照無作為化二重盲検比較試験です。
糖尿病基礎治療に加えてジャディアンス10mgまたはプラセボを52週間投与し、主要評価項目としてHbA1cのベースラインからの変化量、副次評価項目として体組成、握力、5回椅子立ち上がりテストの所要時間のベースラインからの変化量、統計解析書での事前規定項目として体重のベースラインからの変化量について、検討しました。

患者背景は、平均年齢がジャディアンス群74.2歳、プラセボ群74.0歳、平均BMIがそれぞれ25.7kg/m2、25.4kg/m2、平均HbA1cは両群とも7.6%でした。
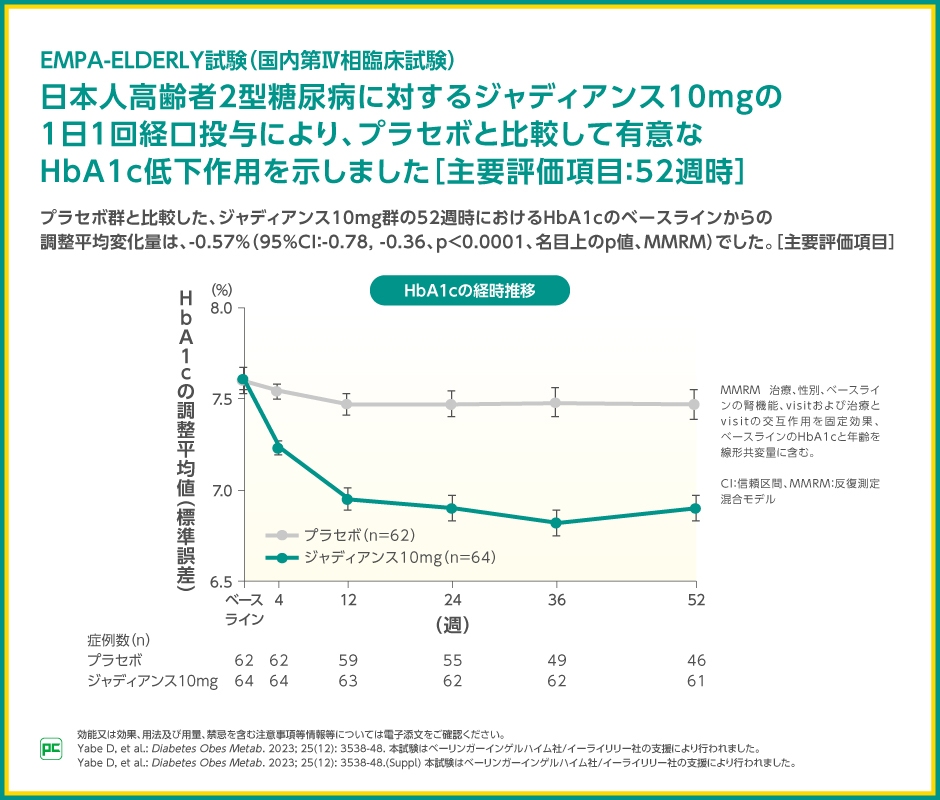
日本人高齢者2型糖尿病に対するジャディアンス10mgの1日1回経口投与による、プラセボ群と比較したジャディアンス10mg群の52週時のHbA1cのベースラインからの変化量は-0.57%であり、ジャディアンス10mg群で有意なHbA1c低下作用を示しました(p<0.0001、名目上のp値、MMRM)。
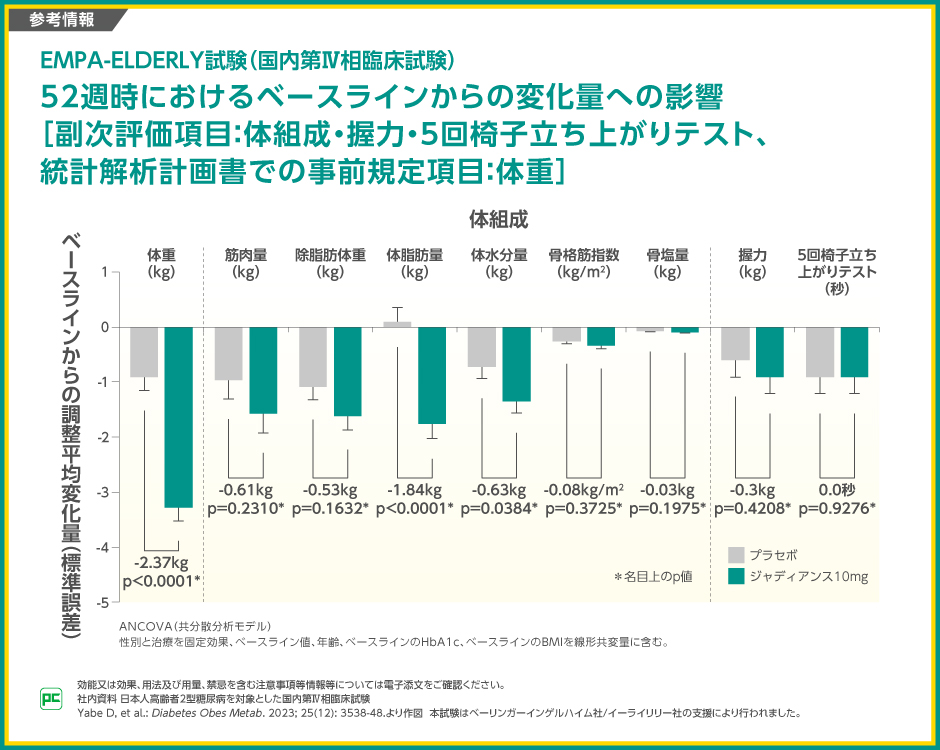
【参考情報】
52週時のベースラインからの変化量の、ジャディアンス10mg群とプラセボ群の差は、体重が-2.37kg(p<0.0001)、筋肉量が-0.61kg(p=0.2310)、除脂肪体重が-0.53kg(p=0.1632)、体脂肪量が-1.84kg(p<0.0001)、体水分量が-0.63kg(p=0.0384)、骨格筋指数が-0.08kg/m2(p=0.3725)、骨塩量が-0.03kg(p=0.1975)、握力が-0.3kg(p=0.4208)、5回椅子立ち上がりテストが0.0(p=0.9276、いずれも名目上のp値 、ANCOVA)でした。
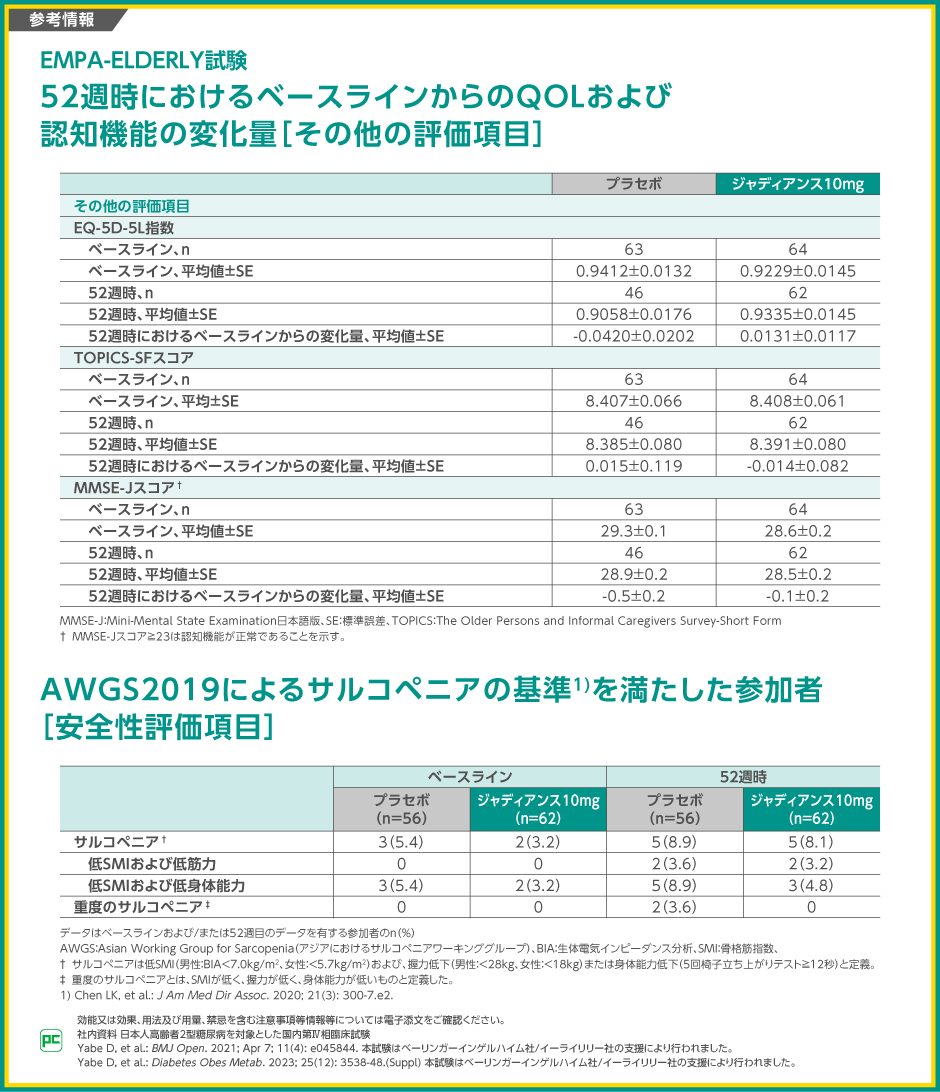
【参考情報】
QOLの指標であるEQ-5D-5L指数の52週時のベースラインからの変化量は、ジャディアンス10mg群で0.0131±0.0117、プラセボ群で-0.0420±0.0202でした。
また、認知機能の指標となるMMSE-Jスコアの52週時のベースラインからの変化量は、ジャディアンス10mg群で-0.1±0.2、プラセボ群で-0.5±0.2でした。
AWGS2019によるサルコペニアの基準を満たしたのは、ジャディアンス10mg群のベースライン時で3.2%(2/62例)、52週時で8.1%(5/62例)であり、プラセボ群ではそれぞれ5.4%(3/56例)、8.9%(5/56例)でした。
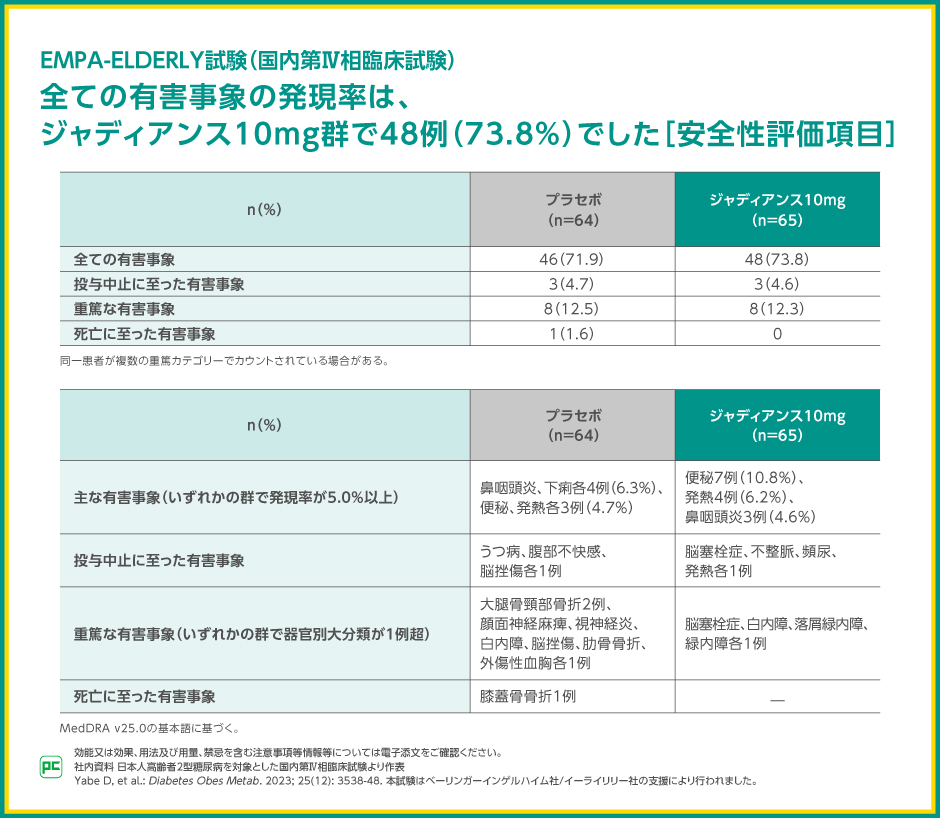
EMPA-ELDERLY試験における有害事象の発現率は、ジャディアンス10mg群で73.8%(48/65例)、プラセボ群で71.9%(46/64例)でした。
投与中止に至った有害事象は、それぞれ4.6%(3/65例)、4.7%(3/64例)、重篤な有害事象はそれぞれ12.3%(8/65例)、12.5%(8/64例)、死亡に至った有害事象はプラセボ群1.6%(1/64例)で、ジャディアンス10mg群では報告されませんでした。
主な有害事象は、ジャディアンス10mg群で便秘10.8%(7/65例)、発熱6.2%(4/65例)等、プラセボ群で鼻咽頭炎、下痢が各6.3%(4/64例)等でした。
ジャディアンスのエビデンス② 日本におけるジャディアンス特定使用成績調査

また、日本におけるジャディアンスの安全性を評価するため、特定使用成績調査が実施されました。
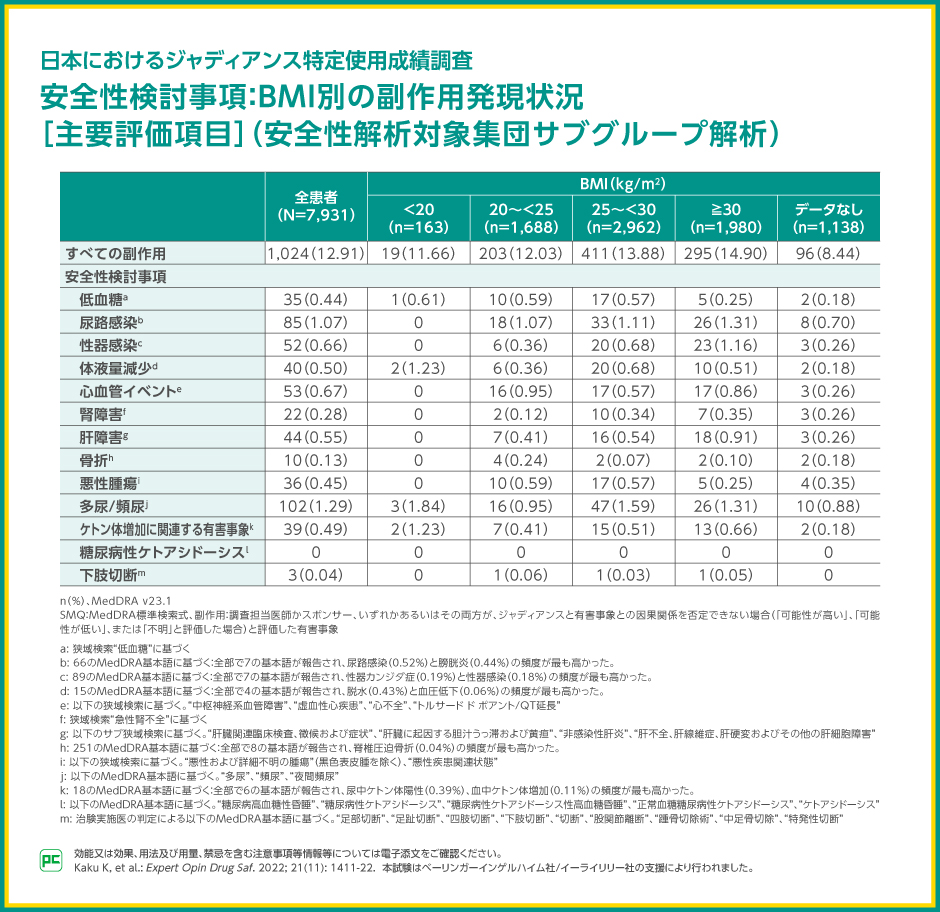
副作用は全患者の12.91%で報告されました。事前規定されたBMI別のサブグループ解析では、BMI 20kg/m2未満群の11.66%、20kg/m2以上25kg/m2未満群の12.03%、25kg/m2以上30kg/m2未満群の13.88%、30kg/m2以上群の14.90%で副作用が報告されました。
安全性検討事項である低血糖は、BMI 20kg/m2未満群の0.61%、20kg/m2以上25kg/m2未満群の0.59%、25kg/m2以上30kg/m2未満群の0.57%、30kg/m2以上群の0.25%で報告されました。糖尿病性ケトアシドーシスは報告されませんでした。
その他の安全性検討事項の発現率は、表の通りでした。
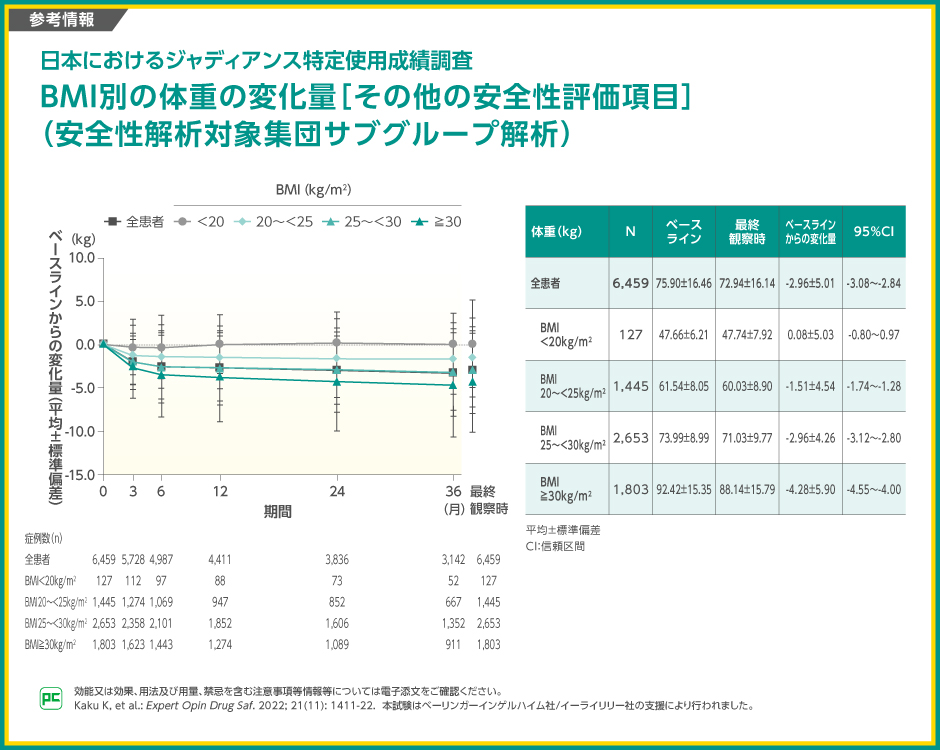
【参考情報】
ベースラインからの体重の平均変化量は、全患者で-2.96kg、BMI 20kg/m2未満群で0.08kg、20kg/m2以上25kg/m2未満群で-1.51kg、25kg/m2以上30kg/m2未満群で-2.96kg、30kg/m2以上群で-4.28kgと報告されました。
ジャディアンスのエビデンス③ 2型糖尿病における心不全への影響
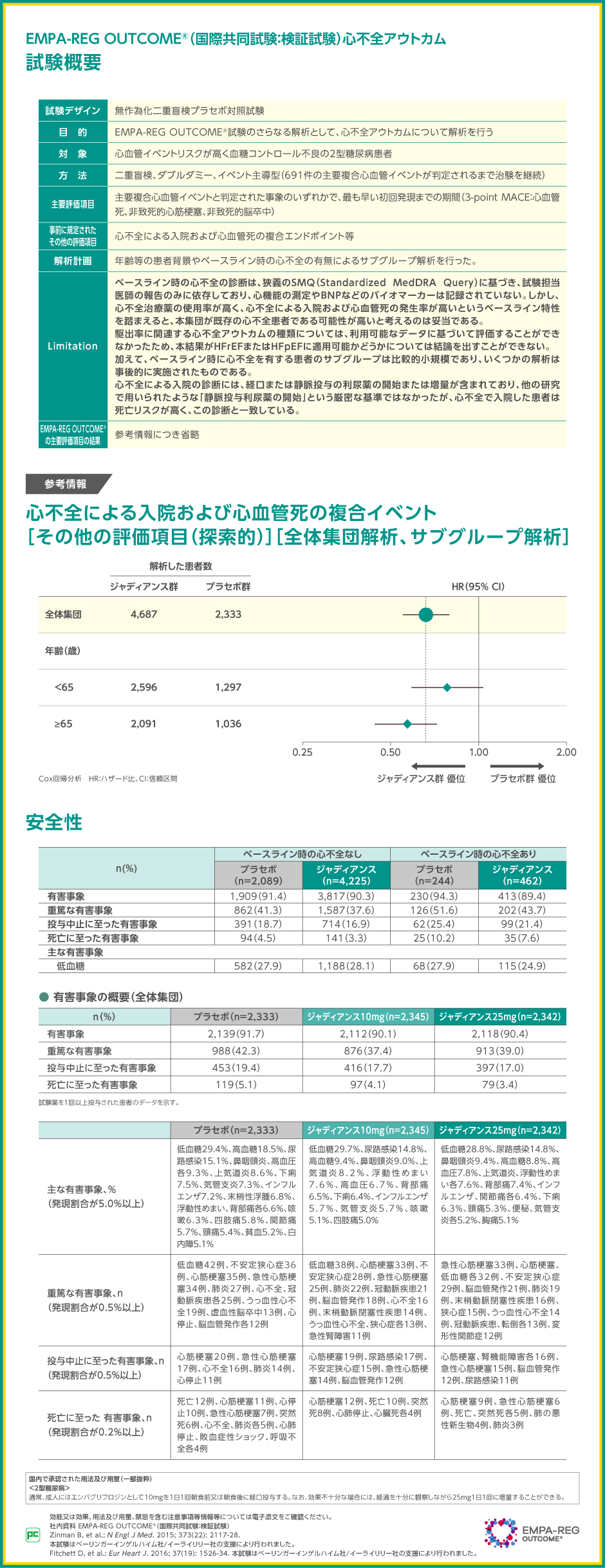
EMPA-REG OUTCOME®では、高血圧、脂質異常症等に対してガイドライン等で推奨される標準治療(スタチン、ACE阻害薬、ARB、アスピリン、β遮断薬、カルシウム拮抗薬の投与等)にジャディアンスを上乗せした場合の心不全に対する影響を検討しました。
【参考情報】
プラセボ群と比較したジャディアンス群の心不全による入院または心血管死のハザード比は、全体解析で0.66(95%CI:0.55~0.79、p<0.001、名目上のp値、Cox比例ハザードモデル)でした。また、事前規定された年齢別のサブグループ解析では、65歳未満、65歳以上とも、プラセボ群と比較したジャディアンス群の心不全による入院または心血管死のハザード比の点推定値が1.00未満でした。
本試験での有害事象の発現率は、ベースライン時に心不全がある場合でプラセボ群94.3%(230/244例)、ジャディアンス群89.4%(413/462例)、ベースライン時に心不全がない場合でプラセボ群91.4%(1,909/2,089例)、ジャディアンス群90.3%(3,817/4,225例)でした。投与中止に至った有害事象、重篤な有害事象および死亡に至った有害事象の発現率は、こちらの表の通りで、それぞれの内訳について論文に記載がありませんでした。
主な有害事象は低血糖で、心不全がある場合でプラセボ群27.9%(68/244例)、ジャディアンス群24.9%(115/462例)、心不全がない場合でプラセボ群27.9%(582/2,089例)、ジャディアンス群28.1%(1,188/4,225例)に認められました。

糖尿病治療の目的は、糖尿病の合併症の発症・進展を阻止し、糖尿病のない方と変わらない寿命とQOLの実現を目指すことです1)。
高齢者2型糖尿病の腎機能の低下リスクを考慮した治療に、ぜひジャディアンスの処方をご検討ください。
- 日本糖尿病学会編・著. 糖尿病治療ガイド2024, p21, 文光堂, 2024
その他の関連情報

日本ベーリンガーインゲルハイム
メディカルチャット 利用規約
当社の「日本ベーリンガーインゲルハイム メディカルチャット」(以下「本サービス」といいます)のご利用に際しては、本利用規約が適用されますので、必ず以下の記載事項をご確認下さい。
利用規約
- 本サービスは、当社所定のウェブページから文字によりお問い合わせいただくことにより、当社医薬品等に関する一般的な情報を、人工知能あるいは当社担当者により、文字及び図表により回答するサービスです(以下、人工知能による回答サービスを「AIチャット」、当社担当者による回答サービスを「有人チャット」といいます。)。ただし、AIチャットによる回答を原則とし、有人チャットは、AIチャットでの回答に対し、有人チャットでの回答も希望された場合に、提供させていただきます。
- 本サービスをご利用いただくことができるのは、当社医薬品等を扱いかつ国内に在住する医療関係者の方に限られます。当該医療関係者以外の方は、ご利用いただくことができません。
- 本利用規約に同意いただけない場合、本サービスを利用いただくことができません。本利用規約を最後までお読みいただき、「同意して利用する」ボタンを押した上で、本サービスをご利用下さい。
- 本サービスは、当社医薬品等に関する一般的なお問い合わせに対して回答するものとし、次の各号に掲げるお問い合わせについては、回答しないものとします。
- 当社医薬品等と関係のないお問い合わせ、または本サービスの回答範囲を逸脱したお問い合わせ
- 具体的な症状や治療方法に関するお問合せ
- 当社に適用される法令、ガイドラインまたは行政上の指導、当社自主規制その他当社が遵守すべきルールにより回答できないお問い合わせ
- 文字化け等により入力内容が判断できないお問い合わせ
- 前各号に掲げるほか、本サービスにより、適切な回答をすることができないと当社が判断した事項に関するお問い合わせ
- 本サービスは、日本語のみに対応しています。
- 本サービスは、当社医薬品の副作用、不具合及び有害事象の報告を受け付けていません。
- お問い合わせの内容によっては、本サービスでは十分に回答できない場合もございます。予めご了承下さい。
- 本サービスの利用可能時間は、以下のとおりです。
- AIチャット
24時間365日 - 有人チャット
平日9:00~17:00
- AIチャット
- 前項に関わらず、メンテナンス及び障害等のため一時的に本サービスを中断する場合がございます。
本サービスのご利用の際には、原則として、個人情報(お名前、ご住所、電話番号、メールアドレス等)を入力しないようお願いします。ただし、AIチャット及び有人チャットを問わず、当社医薬品の適用外使用に関するお問い合わせについては、コンプライアンス上の理由により、当社より、氏名及び施設名の入力を求める場合がございます。この場合には、当社プライバシーポリシーの内容を確認いただき、同意いただける場合に限り、入力して下さい(プライバシーポリシーについては「VIII 利用規約、プライバシーポリシー」に記載のURLからアクセス下さい)。その他の場合に、当社より個人情報の入力を求めることは一切ございません。
- 当社医薬品のご使用にあたっては、最新の添付文書等をご確認下さい。
- 当社は、本サービスまたは本サービスにより提供される情報の利用に際し生じた結果については、一切責任を負いません。
本サービスの利用にあたり、以下の各号の行為を禁止します。
- 本サービスにより提供される情報を複製、複写、転載、改変等する行為
- 第三者または当社の知的財産権その他の権利を侵害する行為
- 第三者または当社を誹謗中傷し、または名誉・信用を毀損する行為
- 本サービスの利用による営利目的の行為
- 本サービスの運営又は他の利用者による本サービスの利用の妨げとなる行為
- 前各号のほか、当社が不適当であると判断する行為
当社は、いつでも本サービスの提供を終了、またはその内容を変更することができるものとします。
本サービスの利用に関しては、以下の利用規約及びプライバシーポリシーが併せて適用されますので、ご確認下さい。



